عوامل پایداری پروتئین ها
لطفا برای بهتر شدن شرایط داروسازی کشور و بهبود سلامت عمومی ایران در نظر سنجی زیر شرکت کنید.
عوامل پایداری پروتئین ها
ساختار اول: اسید های آمینه به وسیله ی پیوند پپتیدی به هم متصل می شوند تا زنجیره های پلی پپتیدی را تشکیل دهند.علت پایداری : پیوند پپتیدی
ساختار دوم : زنجیره ها میتونن به صورت ساختار های منظم تاخوردگی پیدا کنن.مثل مارپیچ آلفا و صفحه ی بتا.علت پایداری : ساختار دوم دو ساختار تکرار شونده به نام های مارپیچ آلفا و صفحه ی بتا دارد.مارپیچ آلفا و صفحه ب بتا و پیچش توسط یک الگوی منظم از پیوند های هیدروژنی تشکیل میشن که بین گروه های n-h و c=o اسید های آمینه ای که در یک توالی خطی پپتیدی نزدیک هم قرار دارند ایجاد میشه.
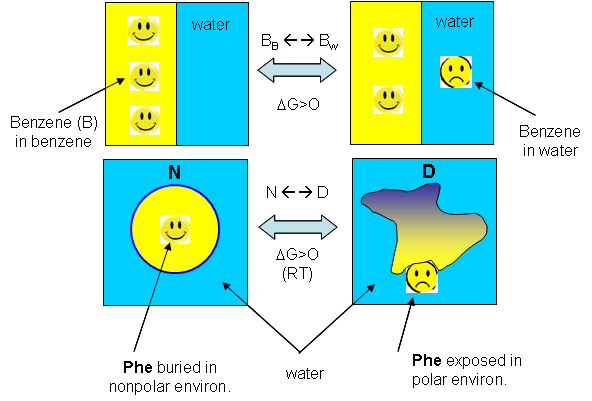
ساختار سوم : پروتیین هایی که در آب محلول هستند با ساختار های فشرده با هسته های غیرقطبی تا میخورند.علت پایداری :یک سیستم زمانی به لحاظ ترمودینامیکی پایدار تره که گروه های آب گریزش به جای پراکنده شدن در آب ، جمع بشن.که به الگوی پیوند دی سولفید هم مرتبطه که خودتون دربارش بحث کردید.
ساختار چهارم: زنجیره های پلی پپتیدی میتونن به صورت ساختار های چند زیر واحدی کنار هم جمع بشن.
ساختار چهارم به نظام خاصی که بین زیر واحد ها برقرار میشود و به ماهیت برهمکنش هایشان مربوط می باشد.
پروتئین از کله یونانی Proteios به معنی مهمترین گرفته شده است و پلی مری است از اسید آمینه ها یی که به هم از طریق پیوند های پپتیدی متصل شده اند ، حاصل شده است که حاوی 100 الی 3000 اسید آمینه است. چنانچه وزن مولکولی یک اسید آمینه به طو متوسط 110 باشد وزن مولکولی پروتئین ها بین 10000 تا 300000 می باشند ( دالتون = وزن برابر یک اتم هیدروژن)
نقش پروتئین ها بسیار متقاوت است : به عنوان آنزیم ، منابع ذخیره کننده نیتروژن برای واکنش های بیولوژِکی ، هورمون ها ، اتصال دهنده مثل هموگلوبین ، آنتی بادی ها و ... . تعداد پیوند های پروتئین بستگی به تعداد اسید های آمینه داشته و n-1 می باشد .
چنانچه تعداد اسید های آمینه کمتر از 10 باشد به آن الیگو پپتید و اگر بیش تر از 101 تا باشد به آن پلی پپتید گویند
ساختمان پروتئین ها :
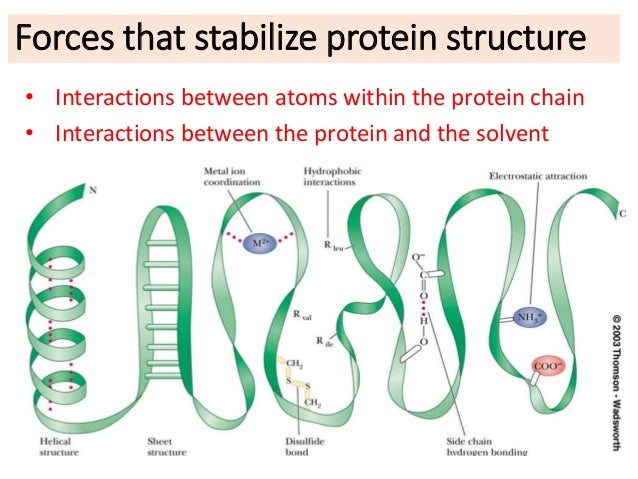
فعالیت اصلی پروتئین وابسته به ساختمان فضایی آن هاست .چهار ساختمان فضایی برای پروتئین ها در نظر گرفته شده است .
ساختمان اول پروتئین
در حقیقت ترتیب قرار گرفتن اسید آمینه در زنجیر پروتئین است . در جقیقت اسید های آمینه بر مبنای پیش نوشته ای که مواد شیمیایی سلول را تعیین می کند به زنجیر پروتئینی می چسبد . حال چنانچه جای یک اسید آمینه در زنجیر عوض گردد خاصیت آن پروتئین از بین می رود .
البته در برخی از پروتئین ها باند های دی سولفیدی Disulphide بین سیستئین یک زنجیر با سیستین زنجیر مجاور نیز صورت می گیرد . که این اسید آمینه سیستین را به نام Cystin گویند .
برای تعیین ساختمان اول پروتئین ، ابتدا آن را خالص و سپس از طریق کروماتوگرافی و الکتروفورز ( میدان الکتریکی) اسید آمینه ی آن را مشخص می کنند.

 ساختمان دوم پروتئین :
ساختمان دوم پروتئین :
در حقیقت نشان دهنده ی شکل فضایی یک پروتئین است . به طوری که باند پپتیدی می تواند معین شود و ممکن است به دو شکل مارپیچ و پله ای در آید . در این وضعیت پیوند های هیدروژنی بین اتم های هیدروژن موجود در NH2 و C=O بوجود می آید. هر چند که پیوند های هیدروژنی بسیار ضعیف هستند ولیکن باعث بوجود آوردن شکل خالص ساختمان دوم پروتئین ها می شود .
در برخی اوقات پیوند های هیدروژنی در گروه های نزدیک به یکدیگر صورت می گیرد و منجر به بوجود آوردن Helix شده که به آن آلفا هلیکس گویند. در این گونه فرم ها 3.6 اسید آمینه در هر چرخش وجود دارد که هر کدام 0.54 نانو متر جا در زنجیر اشغال می کند . برخی از پروتئین ها همچون پروتئین های موجود در سم و پشم و مو به صورت Helix هستند . نوع دیگر که به نام β-phated sheet (صفحه چین خورده) معروف است به دلیل پیوند های هیدروژنی بین گروه های پپتیدی حاصل شده و بسیار قوی هستند . این گردش یا چین خوردگی ها ممکن است راست گرد یا چپ گرد باشند .
- ورقه بنای چین دار آنتی پارالل بوده به طوریکه زنجیره پلی پپتیدی در کنار هم قرار گرفته و در جهت مخالف یکدیگر ادامه می یابد.
- پیوند های هیدروژنی بین گروه های NH و C=O زنجیر جانبی موجب استحکام ساختمان می شود .
- گروه های R در پایین و بالای ورقه قرار می گیرند .
کراتین ها دو نوع هستند
آلفا کراتین : رشته ای غیر محلول در آب ، منشا حیوانی دارند ، مثل پشم ، فلس مو و ناخن و سم و ابریشم و شاخ . این کراتین ها سخت و شکننده بوده مثل ناخن شاخ و درصد سیستئین در آن ها بالاست (22% کل اسید آمیه ) . نوع دیگر کراتین های آلفا فرم قابل انعطاف مثل پوست و مو پشم اند که درصد سیستئین آن ها 10 تا 14 % است .
کراتین های بتا : ساختمان آن ها صفحات چین دار است . فاقد سیتین و سیستئین بوده و از اسید های آمینه ای که کربن جانبی آن ها کوچک است تشکیل شده است . به خصوص گلایسین ، آلانین ، سرین مثل تار عنکبوت و تار کرم ابریشم ، فلس ، چنگال و منقار پرندگان ( فاقد پیوند های دی سولفیدی است)
مهمترین تفاوت بین کراتین های آلفا و بتا این است که کرایتن های آلفا در مقابل حرارت و رطوبت کش می آورند و بلند می شوند و در اثر سرما منقبض می شوند و به حالت قبل باز می گردند ولیکن در نوع بتا این گونه نیست
ساختمان سوم پروتئین ها
با طولانی شدن زنجیر پروتئینی و وجود اسید آمینه ای همچون پرولین خمیدگی در زنجیر حاصل می شود که در مجموع پروتئین ساختمان کروی به خود می گیرد . خمیدگی در قسمت های مختلف یک زنجیر سبب نزدیک شدن گروه های جانبی R شده و سبب تشکیل پیوند های هیدروژنی ، یونی ، هیدروژنی و دی سولفیدی ( در نتیجه نزدیک شدن اسید آمینه سیستین یه یکدیگر ) حاصل می شود و به ساختمان سوم پروتئین پایداری بیشتری می دهد . میو گلوبین که پروتئین رنگی با یک حلقه هم است و اتصال اکسیژن در عضلات را بر عهده دارد از یک زنجیر پپتیدی با ساختمان سوم تشکیل شده .

پایداری ساختمان سوم به 5 دلیل است
ü پیوند هیدروژنی بین گروه های پپتیدی
ü پیوند هیدروژنی بین گروه های R
ü کشش های هیدروفوبیکی بین گروه های جانبی غیر قطبی
ü پیوند های یونی (الکترواستاتیکی) بین گروه هایی که دارای بار مثبت و منفی هستند
ü پیوند های دی سولفیدی
ساختمان چهارم
برخی از پروتئین ها بیش از یک زنجیر پلی پپتیدی دارند . هموگلوبین 4 زنجیر ، کلاژن 3 زنجیر و علاوه بر آن ممکن است برخی از پروتئین ها دارای یک گروه Prostheic هم باشند که اسید آمینه نباشد ولیکن برای فعالیت آن پروتیئن مورد نیاز و ضروری باشد . گروه های Prostheic ممکن است کربوهیدرات یا متان هم باشد .

به طور کلی ریشه های R زنجیر های پلی پپتیدی بین هم از طریق پیوند های ضعیف شیمیایی به یکدیگر متصل و در کنار هم قرار گیرند و تفاوت آن با ساختمان نوع سوم این است که در ساختمان نوع سوم پیوند های ضعیف بین ریشه های R یک زنجیر پلی پپتیدی صورت می گرفت ولی در ساختمان نوع چهارم این پیوند های بین دو زنجیر R جداگانه می باشد .
عواملی که بر روی ثابت انحلال پروتئین ها تاثیر دارند
PH ، قدرت یونی ، خواص دی الکتریک حلال ، حرارت
-PH انحلال بیشتر پروتئین ها ی کروی تحت PH سیستم قرار دارد. به عنوان مثال قابلیت انحلال بتالاکتوگلوبولین (یکی از پروتئین ها یشیر) در PH=5.2 از کمترین مقدار برخوردار است . ولی با تغییر PH قابلیت انحلال آن سریعاً افزایش می یابد چون از نقطه ایزوالکتریک دور می شود. در PH ایزوالکتریک مولکول ها دارای بار خاصی نبوده و هیچ نیروی الکترواستاتیکی وجود ندارد که آنها را از هم دفع کند به همین دلیل مولکول ها میل به تجمع در رسوب دارند ولی با تغییر PH ایزوالکتریک ایجاد بار شده و مولکول های پروتئین همدیگر را دفع می کنند.

قدرت یونی
نمک های خنثی در قابلیت انحلال پروتئین های کروی بسیار موثرند. بعبارتی بیشتر پروتئین ها در آب خالص کاملاً نامحلول هستند ولیکن با افزودن مقدار کمی املاح غیر آلی میزان حلالیت پروتئین افزایش می یابد ولیکن چنانچه مقدار زیادی از این املاح افزوده شود محلولیت پروتئین ممکن است کاهش یابد. این پروسه را به ترتیب Salting in و salting out گویند.
مهمترین فاکتوری که بر روی محلولیت پروتئین تاثیر می گذارد قدرت یونی محلول است تا غلظت نمک . قدرت یونی به صورت زیر تعریف می شود.ü Ci غلظت یون
ü Zi بار الکتریکی یون
خاصیت دی الکتریکی : افزودن برخی از حلال های آلی مثل اتانول و استون می تواند قابلیت انحلال پروتین را کاهش داده و آن ها را رسوب دهد . چون ثابت دی الکتریک اتانول و استون پایین تر از آب است افزودن آن ها به محلول آبی منجر به کاهش نیروی جاذبه بین بارهای مخالف شده و موجب کاهش یونیزاسیون گروه های R می گردد.
اثر حرارت تاحدی با افزایش حرارت می توان انحلال پروتئین را افزایش داد . در دمای بیش از 50 درجه بیشتر پروتئین ها دناتوره می شوند . تمامی پروتئین ها در درجه حرارت های پایین پایدارند.