آنزیم ها
مهمترین گروه از پروتئینها هستند که انجام واکنشهای بیوشیمیایی و سرعت بخشیدن به آنها را بر عهده دارند و به همین دلیل این ترکیبات کاتالیزگرهای زیستی نامیده میشوند که به عنوان کاتالیزگرهای یاختهای نیز معروفند.
آنزیمها ترکیباتی هستند که میتوانند سرعت واکنش را تا حدود 107 برابر افزایش دهند. آنزیم مانند یک کاتالیزگر غیر آلی میزان واکنش را با پایین آوردن انرژی فعال سازی واکنش لازم برای انجام واکنش تسریع میکند و برخلاف آن انرژی فعال سازی را با جایرگزین کردن یک سد انرژی فعال سازی بزرگ با یک سد انرژی سازی کوچک پایین میآورد. انجام سریع یک واکنش در موقعیت آزمایشگاهی به شرایط ویژهای مانند دما و فشار بالا نیاز دارد. لذا باید در یاخته که شرایط محیطی در آن کاملا ثابت است و انجام چنین واکنشهایی بسیار کند است، مکانیسمی دقیق وجود داشته باشد. این عمل بوسیله آنزیمها صورت میگیرد.
کاتالیزورها در واکنشها بدون تغییر میمانند، ولی آنزیمها مانند سایر پروتئینها تحت شرایط مختلف پایدار نمیمانند. این مواد در اثر حرارت بالا و اسیدها و قلیاها تغییر میکنند. کاتالیزورها تاثیری در تعادل واکنش برگشت پذیر ندارند، بلکه فقط سرعت واکنش را زدیاد میکنند تا به تعادل برسند. آنزیمها با کاهش انرژی فعال سازی (activation) سرعت واکنش شیمیایی را افزایش میدهند.
آنزیمها مولکولهای پروتئینی هستند که دارای یک یا چند محل نفوذ سطحی (جایگاههای فعال) هستند که سوبسترا یعنی مادهای که آنزیم بر آن اثر میکند، به این نواحی متصل میشود. تحت تاثیر آنزیمها ، سوبسترا تغییر میکند و به یک یا تعدادی محصول تبدیل میشود.

تاریخچه
کشف آنزیمها در واقع به پژوهشهای وسیع پاپن و پرسوز وابسته بود. آنان در سال 1833 موفق شدند از جو سبز شده ترکیبی را به نام مالت کشف کنند که نشاسته را به قند مبدل میساخت و این ترکیب را دیاستاز نامیدند که امروزه به نام آنزیم آمیلاز معروف است. چند سال بعد شوان برای نخستین بار آنزیم پپسین را که موجب گوارش گوشت میشد، کشف کرد و همین طور ادامه پیدا کرد اما وکونه نخستین کسی بود که آنزیم را بجای دیاستاز بکار برد.
سیر تحولی و رشد
بیشتر تاریخ بیوشیمی ، تاریخ تحقیق آنزیمی است. کاتالیز بیولوژیکی برای اولین بار در اواخر قرن 18 طی مطالعات انجام شده بر روی هضم گوشت توسط ترشحات معده انجام شد. بعد بوسیله تبدیل نشاسته به قندهای ساده توسط بزاق ادامه یافت. « لویی پاستور » گفت که تخمیر قند به الکل توسط مخمر بوسیله خمیر مایه کاتالیز میشود.
بعد از پاستور ، « ادوارد بوخنر » ثابت کرد که تخمیر توسط مولکولهایی تسریع میگردد که بعد از جدا شدن از سلولها ، همچنان فعالیت خود را ادامه میدهند. « فردریک کوهن » این مولکولها را "آنزیم" نامید.
جداسازی و کریستالیزه کردن آنزیم « اوره آز » در سال 1926 توسط « جیمز سامند » منجر به رفع موانع در مطالعات اولیه آنزیم شناسی گردید.

ساختار آنزیمها
آنزیمها ماهیتی پروتئینی دارند و ساختار بعضی ساده یعنی از یک زنجیره پلی پپتیدی ساخته شدهاند و بعضی الیگومر هستند. ساختار بعضی از آنزیمها منحصرا از واحدهای اسید آمینه تشکیل یافته اما برخی دیگر برای فعالیت خود نیاز به ترکیبات غیر پروتئینی دارند که به نام گروه پروستتیک معروف است و این گروه میتواند یک فلز یا یک کو آنزیم باشد و با آنزیم اتصال محکمی را برقرار میکنند. بخش پروتئینی آنزیم (بدون گروه پروستتیک) آپوآنزیم نام دارد و مجموع آنزیم فعال از نظر کاتالیزوری و کوفاکتور مربوطه هولوآنزیم نام دارد.
طبقه بندی آنزیمها
آنزیمها را از نظر فعالیت کاتالیزی به شش گروه اصلی تقسیم میکنند.
اکسید و ردوکتازها :واکنشهای اکسید و احیا (اکسایش – کاهش) را کاتالیز میکند (دهیدروژناز)
ترانسفرازها : انتقال عوامل ویژهای مانند آمین ، فسفات و غیره را از مولکولی به مولکول دیگر به عهده دارند و مانند آمینو ترانسفرازها که در انتقال گروه آمین فعال هستند.
هیدرولازها : واکنشهای آبکانتی را کاتالیز میکنند. مانند پپتیدازها که موجب شکسته شدن پیوند پپتیدی میشوند.
لیازها : موجب برداشت گروه ویژهای از مولکول میشوند. مانند دکربوکسیلازها که برداشت دیاکسید کربن را برعهده دارند.
ایزومرازها : واکنشهای تشکیل ایزومری را کاتالیز میکنند. مانند راسه ماز که از L- آلانین ترکیب ایزومریD- آلانین را میسازد.
لیگازها : آنزیمهایی هستند که باعث اتصال دو مولکول به یکدیگر و ایجاد پیوند کووالانسی بین آنها میشوند. مانند استیل کوآنزیم A سنتتاز که موجب سنتز استیل کوآنزیم A میگردد.



طرز کار آنزیمها
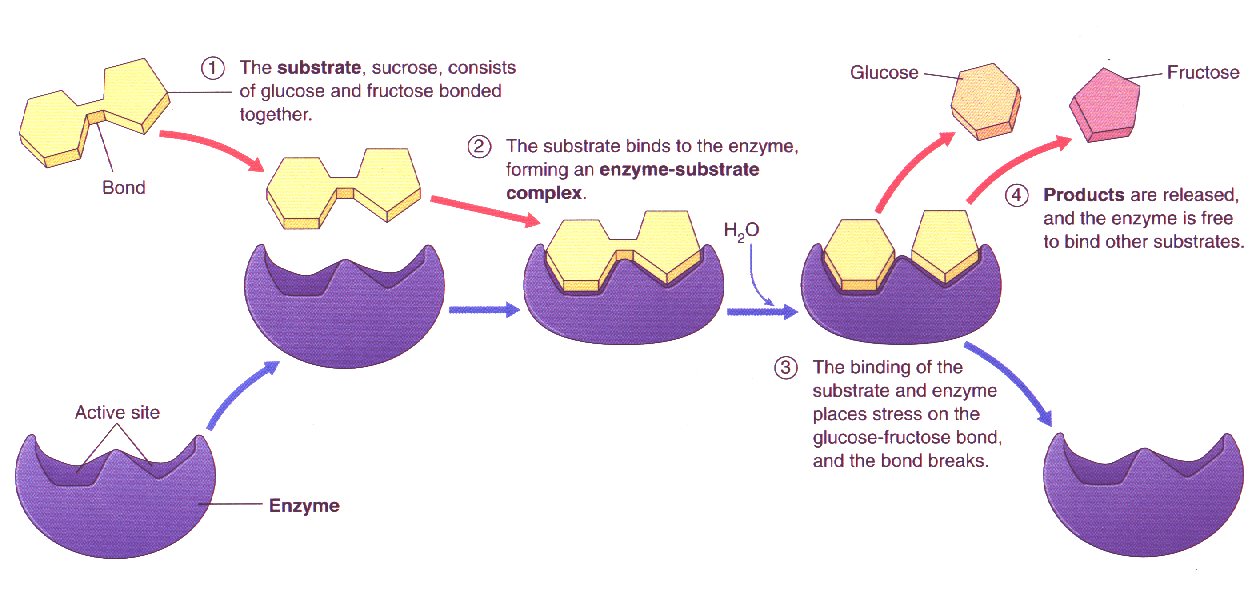
از ویژگیهای مهم آنزیمها این است که پس از انجام هر واکنش و در پایان آن سالم و دست نخورده باقی میمانند و میتوانند واکنش بعدی را کاتالیز کنند. در یک واکنش ساده ابتدا آنزیم (E) با ماده اولیه یا سوبسترا (S) ترکیب میشود و کمپلکس آنزیم – سوبسترا میدهد در مرحله بعدی با انجام واکنش ، فراورده یا محصول (P) ایجاد میشود و آنزیم رها میگردد.
P+E←→ES←→S+E

هر آنزیم بر سوبسترای ویژه خود اثر کرده و فرآورده ویژهای را تولید میکند. به این منظور هر آنزیم ساختار سه بعدی ویژه خود را دارا است که آن را برای انجام فعالیت کاتالیزی مناسب میسازد و بخشی از آنزیم که با سوبسترا بند و بست مییابد، جایگاه فعال نام دارد و در مورد اتصال آنزیم به سوبسترا الگوهایی ارائه شدهاند که مدل کوشلند که الگوی القایی نام دارد و حالت دست در دستکش را دارد، نشان میدهد. بطوری که محل اتصال حالت انعطاف پذیری دارد.

عوامل بازدارنده
بعضی از ترکیبات میتوانند با آنزیم – سوبسترا ترکیب و فعالیت سوبسترا ایجاد فرآورده اختصاصی سوبسترای آن را تحت تاثیر قرار دهند و در صورتیکه این ترکیبات موجب تشکیل نشدن فراورده شوند، به نام بازدارندههای آنزیمی نامیده میشوند که به سه نوع زیر موجودند.
بازدارندههای رقابتی.
بازدارندههای نارقابتی.
بازدارندههای بیرقابتی.


پروآنزیم یا زیموژن
برخی از آنزیمها ، ابتدا به صورت پروآنزیم یا زیموژن یا آنزیم غیر فعال در سلول ساخته میشوند و برای شرکت در واکنش و پدیدار شدن خاصیت کاتالیزوری آنها ، باید بوسیله ماده دیگر به صورت فعال درآیند.
عمل متقابل آنزیم و سوبسترا
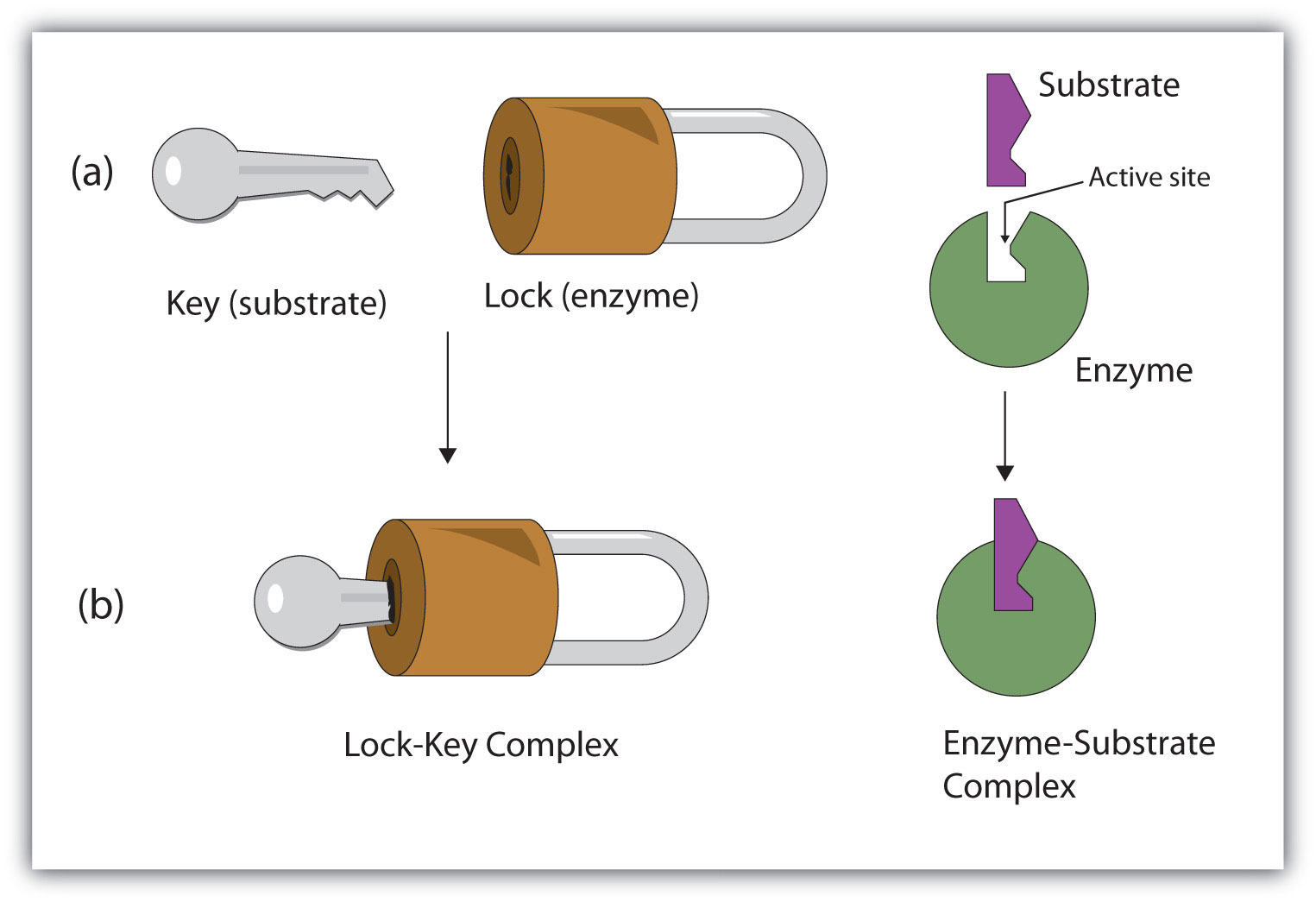
اگر چه میتوان آنزیم و سوبسترا را همانند قفل و کلید تصور کرد، اما این بدان معنی نیست که جایگاه فعال آنزیم ساختمانی سفت و غیر قابل انعطاف است. در بعضی از آنزیمها ، جایگاه فعال فقط بعد از اینکه ماده زمینه به آن متصل شد، دقیقا مکمل سوبسترا میشود. این پدیده تناسب القایی نام دارد.
عمل اختصاصی آنزیمها
برخلاف کاتالیزورهای غیر آلی ، فعالیت آنزیم اختصاصی است، یعنی هر آنزیم میتواند بر سوبسترای مشخص اثر کند. در عین حال درجات مختلفی از تخصص وجود دارد. علت اختصاصی بودن آنزیمها را باید در ساختار فضایی آن جستجو کرد. بعضی از آنزیمها میتوانند نه تنها بر روی یک سوبسترای معین اثر کنند، بلکه قادرند بر روی تمام موادی که دارای یک عامل شیمیایی هستند، موثر باشند. در این صورت کلیدی را که مثال زدیم میتوان به شاه کلیدی تشبیه کرد که قادر است تمام قفل درهای یک راهرو را باز کند.
نامگذاری آنزیمها
در گذشته اسامی آنزیمها بر پایه تخصص آنها یا توان عملشان بر روی یک ماده خاص انتخاب میشد. آنزیمهایی که پلی پپتیدها را به قطعات کوچکتری از زنجیرههای پپتیدی یا به اسیدهای آمینه تجزیه میکنند، بطور کلی پروتئینازها ، نامیده میشوند و ... .
در حال حاضر نامگذاری جدید آنزیمها بطور رسمی بر بنای پیشنهادات کنفرانسهای بینالمللی بیوشیمی صورت میگیرد. در تقسیمبندی جدید آنزیمها را بر حسب واکنشهای شیمیایی که رهبری میکنند، به 6 گروه تقسم بندی میکنند: اکسیدو ردوکتازها - ترانسفرازها - هیدرولازها - لیازها - ایزومرآزها و لیگازها.
چشم انداز بحث
مطالعه آنزیمها دارای اهمیت عملی بیاندازه است. بسیاری از بیماریها بخصوص ناهنجاریهای ژنتیکی ارثی ممکن است به علت عبور یا عدم وجود یک یا چند آنزیم باشد. در مورد حالات دیگر بیماری علت ممکن است افزایش فعالیت یک آنزیم باشد. اندازهگیری فعالیت آنزیمها در پلاسما ، گویچههای قرمز خون یا نمونههای بافتی در تشخیص بعضی از بیماریها دارای اهمیت است. بسیاری از داروها اثر خود را از طریق انجام واکنش با آنزیمها اعمال میکنند. آنزیمها ابزار عملی مهمی در پزشکی ، صنعت شیمی ، پردازش مواد غذایی و کشاورزی هستند.
خلاصه :
آنزیم یا زیمایه[۱] یک ماده آلی است که یک فرایند شیمیایی را در یک سازواره یا موجود زنده تقویت یا تضعیف میکند ولی خودش دگرگون نمیشود. به عبارت دیگر آنزیمها کاتالیزگرهای فرایندهای زیستی هستند و نسبت به کاتالیزگرهای غیر زیستی کارایی بسیار بالایی دارند. اغلب آنزیمها ساختار پروتئینی دارند، به غیر از انواع محدودی از آنها که از جنس ریبونوکلئیک اسید هستند؛ مانند ریبوزیمها.
آنزیمها با پایین آوردن انرژی فعالسازی یک واکنش فعالیت میکنند.
نامگذاری
در گذشته بر اساس پیشماده نامگذاری میشد که به آخر آن "از" اضافه میشد مثل پروتئاز
روش دیگر بر اساس کاری که آن آنزیم انجام میدهد مثل دهیدرژناز
روش پیشرفته تر براساس کاری که انجام میدهد و نام پیشماده الکل دهیدرژناز
روش استاندارد که در این روش آنزیمها ردهبندی شده و ردهها به زیررده تقسیم شده و در نهایت هر آنزیم کد مخصوص به خود میگیرد مثل EC ۱.۱.۱.۸۶
این ردهها به شکل زیر است
۱-اکسیدو رداکتازها
۲-ترانسفرازها
۳-هیدرولازها
۴-لیازها
۵-ایزومرازها
۶-لیگازها
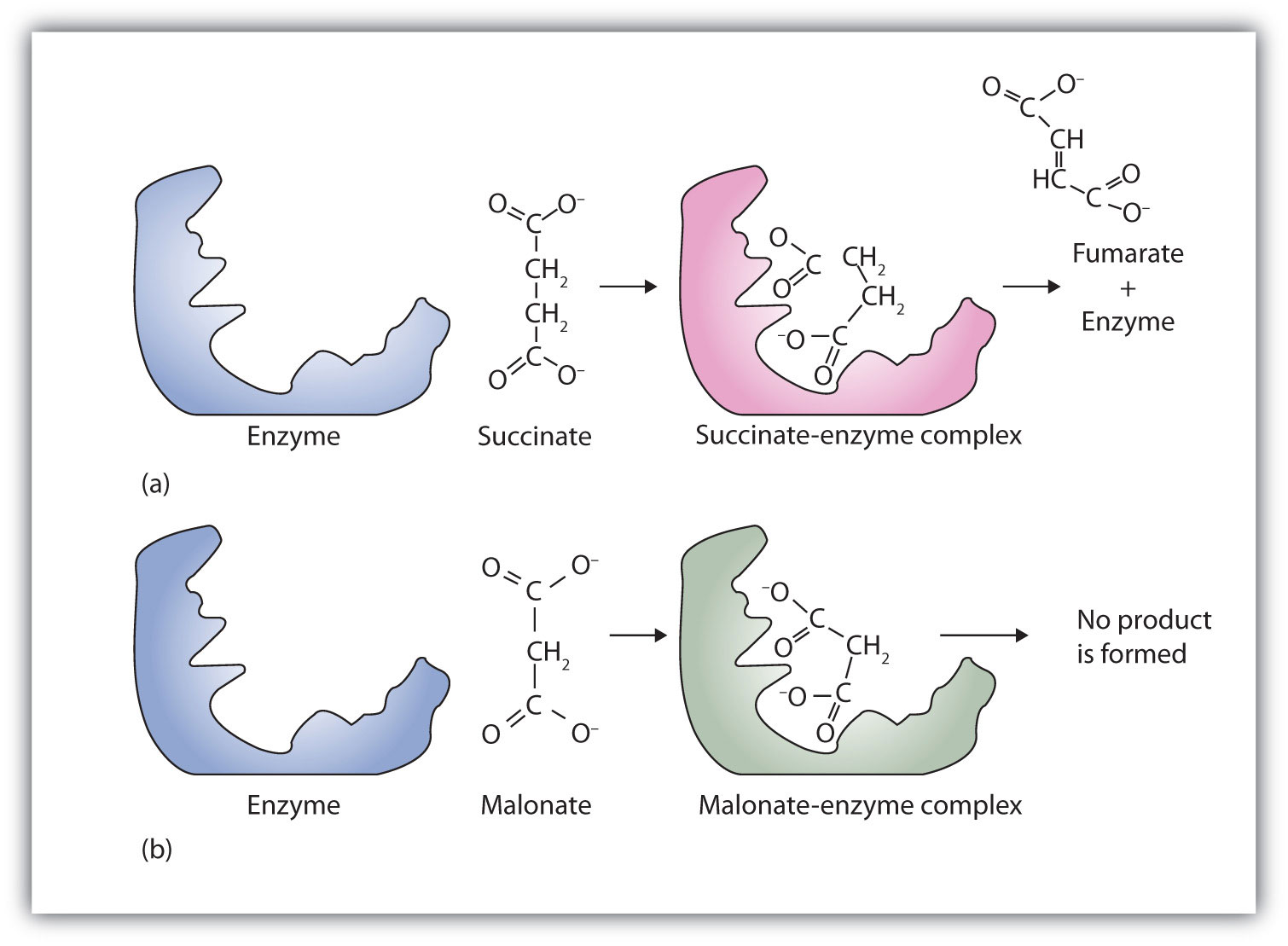
پیشماده یا سوبسترا مادهای است که آنزیم بر آن اثر میکند و تحت تاثیر آنزیمها، سوبسترا تغییر میکند و به یک یا تعدادی محصول تبدیل میشود. هر یک از مولکولهای زیستی و آلی، حتی در بعضی موارد یونها، میتوانند سوبسترا باشند.
کوآنزیمها مولکولهای غیر پروتئینی و آلی هستند که از اجزای برخی آنزیمها میباشند. کوآنزیمها شامل ویتامینهای فسفوریله شدهٔ محلول در آب و برخی مولکولهای غیر ویتامینی و آلی دیگر مانند هم (در هموگلوبین و میوگلولین) میباشند.
به آنزیم بدون کوآنزیم، آپوآنزیم گفته میشود و هنگامی که کوآنزیم وارد ساختار آنزیم میشود، آنزیم کامل، هالوآنزیم نامیده میشود.
لطفا اندیشه و نظر خود را در قسمت نظرات اعلام کرده و بنویسید.
- ۹۳/۰۳/۲۲


