ساختار عمومی آمینو اسید ها
لطفا برای بهتر شدن شرایط داروسازی کشور و بهبود سلامت عمومی ایران در نظر سنجی زیر شرکت کنید.
برای شرکت در نظر سنجی کلیک کنید.
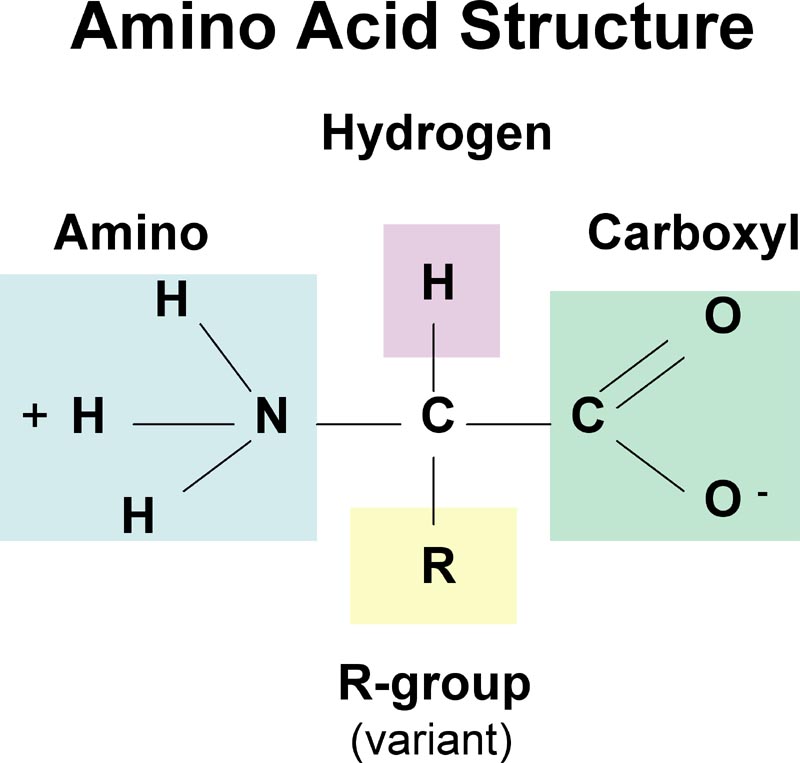
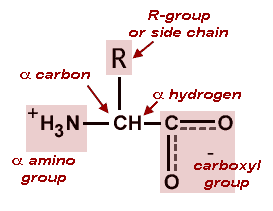
هر اسید آمینه، از یک کربن نامتقارن به نام کربن α تشکیل یافتهاست که با چهار گروه مختلف کربوکسیل (COOH) اتم هیدروژن، گروه آمینه بازی (NH۲-) و یک زنجیره غیر جانبی (R-) پیوند برقرار میکند. ریشه R ممکن است یک زنجیره کربنی و یا یک حلقه کربنی باشد. عوامل دیگری مانند الکل، آمین، کربوکسیل و نیز گوگرد میتوانند در ساختمان ریشه R شرکت کنند. زنجیره جانبی خود چندین اتم کربن دارد و آنها را به ترتیبی که از کربن آلفا، فاصله میگیرند، با حروف بتا (β)، گاما (γ) و دلتا (δ) نشان میدهند. اگر در حالی که عامل COOH روی کربن آلفا قرار داد عامل NH۲ روی کربنهایی غیر آلفا قرار گیرد. نوع اسید آمینه به β، γ یا δ تغییر خواهد کرد. اسیدهای آمینه آزاد به مقدار بسیار ناچیز در سلولها وجود دارند. بیشتر اسیدهای آمینه آلفا در سنتز پروتئین شرکت میکنند، در صورتی که اسیدهای آمینه بتا، گاما و دلتا واسطههای شیمیایی هستند. بیشتر اسیدهای آمینه در pH هفت به صورت دو قطبی در میآیند یعنی گروه NH۲ پروتون میگیرد و گروه COOH هیدروژن خود را از دست میدهد و به صورت –COO- در میآید. زنجیره جانبی (گروه) R برای پروتئینها میتواند یکی از ۲۰ حالت مختلف ممکن باشد و بدین ترتیب یک الفبای بیست حرفی برای ساخت پروتئینها بوجود میآید. این بیست اسید آمینه میتوانند با هر ترکیب و به هر تعداد در ساختار یک پروتئین دخالت کنند.
ساختار اسیدهای آمینه
هر اسید آمینه ، از یک کربن نامتقارن به نام کربن آلفا تشکیل یافته است که با چهار گروه مختلف کربوکسیل (COOH) اتم هیدروژن ، گروه آمینه بازی (NH2-) و یک زنجیره غیر جانبی (R-) پیوند برقرار میکند. ریشه R ممکن است یک زنجیره کربنی و یا یک حلقه کربنی باشد. عوامل دیگری مانند الکل ، آمین ، کربوکسیل و نیز گوگرد میتوانند در ساختمان ریشه R شرکت کنند. زنجیره جانبی خود چندین اتم کربن دارد و آنها را به ترتیبی که از کربن آلفا ، فاصله میگیرند، با حروف بتا (β) ، گاما (γ) و دلتا (δ) نشان میدهند.
اگر در حالی که عامل COOH روی کربن آلفا قرار داد عامل NH2 روی کربنهایی غیر آلفا قرار گیرد. نوع اسید آمینه به β ، γ یا δ تغییر خواهد کرد. اسیدهای آمینه آزاد به مقدار بسیار ناچیز در سلولها وجود دارند. بیشتر اسیدهای آمینه آلفا در سنتز پروتئین شرکت میکنند، در صورتی که اسیدهای آمینه بتا ، گاما و دلتا واسطههای شیمیایی هستند. بیشتر اسیدهای آمینه در PH هفت به صورت دو قطبی در میآیند یعنی گروه NH2 پروتون میگیرد و گروه COOH هیدروژن خود را از دست میدهد و به صورت –COO- در میآید.
ایزومری در اسیدهای آمینه
مطابق قرار داد اگر ساختمان فضایی یک اسید آمینه را در نظر بگیریم، چنانچه عامل NH2 که به کربن آلفا متصل است در طرف چپ باشد، میگوییم که این اسید آمینه از نوع L است و هرگاه عامل NH2 در طرف راست کربن آلفا قرار گیرد، گوییم که این اسید آمینه از نوع ∆ است. برخلاف قندهای طبیعی که از نوع دلتا هستند، اسیدهای آمینه طبیعی همگی از نوع L میباشند. ایزومرها را انانتیومر میگویند.
ساختار کلی آمینو اسید ها
در ساختار نشان داده شده در بالای صفحه، R نشان دهنده یک زنجیره جانبی خاص به هر اسید آمینه. اتم کربن بعدی به گروه کربوکسیل (که در نتیجه در زنجیره کربن با شروع از که گروه عاملی شماره 2) است α کربن نامیده می شود. اسیدهای آمینه حاوی یک گروه آمینو به طور مستقیم به کربن آلفا متصل به اسیدهای آمینه آلفا نامیده می شود. این خدمات عبارتند از اسیدهای آمینه مانند پرولین که حاوی آمین نوع دوم، که استفاده می شود اغلب به عنوان "imino اسیدهای" می گویند.
ایزومر
اسیدهای آمینه آلفا هستند رایج ترین شکل موجود در طبیعت، اما تنها زمانی که در L-ایزومر اتفاق می افتد. کربن آلفا یک اتم کربن کایرال، به استثنای گلیسین است که دو اتم هیدروژن غیر قابل تشخیص از روی کربن آلفا است. بنابراین، تمام اسیدهای آمینه آلفا اما گلیسین می توانید در هر کدام از دو انانتیومر، به نام L یا اسیدهای آمینه D، که تصویر آینه از یکدیگر هستند وجود دارد (همچنین دستسانی را ببینید). در حالی که اسیدهای L-آمینه در طول ترجمه در ریبوزوم نمایندگی از تمام اسیدهای آمینه موجود در پروتئین ها، اسیدهای آمینه در برخی از پروتئین های تغییرات posttranslational آنزیم پس از ترجمه و انتقال به شبکه آندوپلاسمی تولید، به عنوان در موجودات دریا ساکن عجیب و غریب مانند حلزون مخروطی. آنها همچنین اجزای فراوان از دیواره های سلولی پپتیدوگلیکان باکتری هستند، و D-سرین ممکن است به عنوان یک انتقال دهنده عصبی در مغز عمل می کنند. اسیدهای آمینه در کریستالوگرافی راسمیک مورد استفاده برای ایجاد کریستال حول، که (بسته به پروتئین) ممکن است برای تعیین ساختار پروتئین آسان تر و قوی تر می شود. L و D کنوانسیون برای پیکربندی اسید آمینه اشاره دارد نه به فعالیت نوری اسید آمینه خود بلکه به فعالیت نوری از ایزومر گلیسرآلدهید که از آن که اسید آمینه را می، در تئوری، سنتز (D-گلیسرآلدهید dextrorotatory است. L-گلیسرآلدهید چپ گرد است). در مد جایگزین، (S) و (R) دهنده های استفاده می شود برای نشان دادن فضایی مطلق است. تقریبا همه از اسیدهای آمینه در پروتئین ها (S) در کربن α، با سیستئین بودن (R) و گلیسین غیر کایرال. سیستئین است زنجیره جانبی خود را در موقعیت هندسی همان سایر اسیدهای آمینه، اما R / S اصطلاحات است که به دلیل عدد اتمی بالاتر از گوگرد در مقایسه با اکسیژن کربوکسیل معکوس می دهد زنجیره جانبی اولویت بالاتر، در حالی که اتم در بسیاری از دیگر سمت زنجیره آنها اولویت های پایین تر است.
زنجیره های جانبی
لیزین شامل شش اتم کربن. اتم کربن مرکزی متصل به گروه های آمینه و کربوکسیل است آلفا نامیدند. چهار اتم کربن در خطی زنجیره جانبی آن از بتا (نزدیک به کربن مرکزی)، گاما، دلتا، از طریق به کربن اپسیلون در انتهای زنجیره و دورتر از کربن مرکزی برچسب شده است.
Zwitterions (به این معناست که یک ملکول دارای بخش های با بار + و – است.)
یک اسید آمینه است که در دو حالت یونیزاسیون نشان داده شده است. اول، آن را در ترتیب همان تصویر سرب نشان داده شده است. این فرم اتحادیه است. آن را نیز در قالب یونیزه نشان داده شده است، پس از گروه کربوکسیل یک اتم هیدروژن، که به معرفی یک بار منفی از دست داده است، و گروه آمینه یک هیدروژن، که به معرفی یک بار مثبت به دست آورد.
یک اسید آمینه در
(1) دو بار با علامت مختلف
(2) یونیزه
گروه اسید α-کربوکسیلیک اسیدهای آمینه یک اسید ضعیف است، به این معنی است که آن را انتشار HYDRON (مانند یک پروتون) در pH متوسط. به عبارت دیگر، گروه های کربوکسیلیک اسید (-CO2H) را می توان deprotonated برای تبدیل شدن به کربوکسیلات منفی (-CO2-). یون کربوکسیلات بار منفی غالب در pH ارزش بیشتر از مقدار pKa گروه کربوکسیلیک اسید (متوسط برای 20 اسید آمینه مشترک است در مورد 2.2، جدول سازه اسید آمینه را ببینید در بالا). در مد مکمل، α-آمین اسیدهای آمینه پایگاه ضعیف است، به این معنی که یک پروتون در pH متوسط می پذیرد. به عبارت دیگر، گروه α-آمینه (NH2-) را می توان پروتونه برای تبدیل شدن به گروه های α-آمونیوم مثبت (+ NH3-). گروه α-آمونیوم بار مثبت غالب در pH کمتر از مقدار pKa گروه α-آمونیوم (متوسط برای 20 اسید آمینه α-مشترک در مورد 9.4 است.
از آنجا که تمام اسیدهای آمینه حاوی گروه های عاملی اسید آمین و کربوکسیلیک، آنها خواص آمفیروتیک به اشتراک بگذارید.
در زیر به pH 2.2، فرم غالب یک گروه بی طرف کربوکسیلیک اسید و یک یون α-آمونیوم مثبت (بار خالص 1)، و بالاتر از pH برابر 9.4، یک کربوکسیلات منفی و گروه α-آمینه خنثی (بار خالص -1) است. اما در pH بین 2.2 و 9.4، یک اسید آمینه معمولا شامل هر دو کربوکسیلات منفی و یک گروه α-آمونیوم مثبت، به عنوان در ساختار (2) در سمت راست نشان داده شده است، بنابراین خالص شارژ صفر است. این حالت مولکولی به عنوان یک zwitterion شناخته شده است، از آلمان Zwitter معنی نر و ماده یا ترکیبی. فرم را به طور کامل بی طرف (ساختار (1) در سمت راست) نام یک گونه بسیار جزئی در محلول آبی در سراسر محدوده pH (در کمتر از 1 در 107) است. اسیدهای آمینه به عنوان zwitterionsهمچنین در فاز جامد وجود داشته باشد، و متبلور با خواص نمک مانند دوست ندارم اسیدهای آلی معمولی و یا آمین.
نقطه ایزوالکتریک
تغییر در منحنی تیتراسیون که اسیدهای آمینه بر اساس طبقه بندی گروه بندی می شوند در اینجا دیده می شود. به غیر از تیروزین، با استفاده از تیتراسیون به تمایز بین اسیدهای آمینه آبگریز مشکل ساز است.
در pH بین دو مقدار مقدار pKa از zwitterion غالب، اما همزیستی در تعادل پویا با مقادیر کمی از یون های منفی و خالص مثبت. در نقطه میانی دقیق بین دو مقدار مقدار pKa، مقدار اثری از خالص منفی و اثری از یون های مثبت خالص دقیقا تعادل، به طوری که متوسط بار خالص از همه اشکال حاضر صفر است. این PH به عنوان پی نقطه ایزوالکتریک شناخته شده، بنابراین PI = ½ (pKa1 + pKa2). اسیدهای آمینه منحصر به فرد تمام ارزش کمی متفاوت مقدار pKa، بنابراین باید نقاط مختلف ایزوالکتریک. برای اسیدهای آمینه با شارژ جانبی زنجیره ای، از pKa از زنجیره جانبی درگیر است.
بنابراین برای ASP، گلو با جانبی منفی زنجیره، PI = ½ (pKa1 + pKaR)، که در آن pKaR زنجیره جانبی مقدار pKa است. سیستئین همچنین دارای بالقوه منفی زنجیره جانبی با pKaR = 8.14، بنابراین باید به عنوان PI به برای آسپاراژین و گلوتامین محاسبه، حتی اگر زنجیره جانبی به طور قابل توجهی در pH خنثی اتهام نشده است. برای او، لیزین، و ارگ با مثبت سمت زنجیره،
PI = ½ (pKaR + pKa2). اسیدهای آمینه صفر تحرک در الکتروفورز در نقطه ایزوالکتریک خود، اگر چه این رفتار است که معمولا بیشتر برای پپتیدها و پروتئین از اسیدهای آمینه استفاده قرار گیرد. Zwitterions حداقل حلالیت در نقطه ایزوالکتریک خود و برخی از اسیدهای آمینه (به طور خاص، با غیر قطبی جانبی زنجیر) را می توان با بارش از آب با تنظیم pH به نقطه ایزوالکتریک مورد نیاز جدا شده است.
فایل PDF ![]() دریافت
دریافت