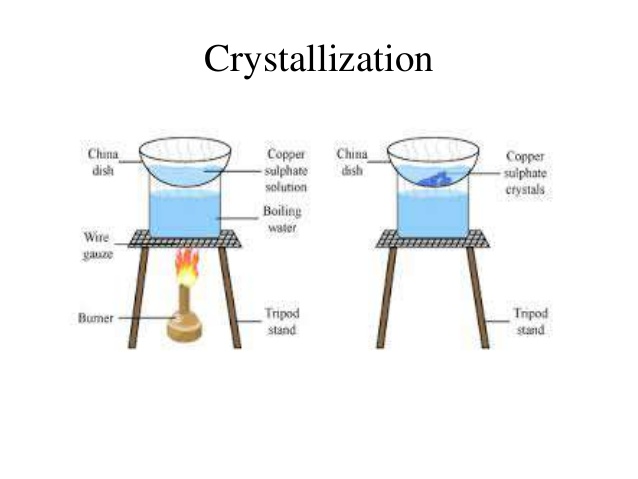
بلور کردن ، جدا کردن اجسام از یکدیگر و تهیه اسید ارتوبوریک (H3BO3)
بلور شدن یکی از راه هایی است که برای خالص کردن اجسام جامد به کار می رود.
اگر محلولی اشباع از یک ماده حل شدنی در یک حلال داشته باشیم ، ذرات ماده حل شدنی می توانند به هم متصل شده و جامد شوند که این عمل ، بلور شدن یا crystallization نامیده می شود.
معرفی کلی بوراکس:
بوراکس : اصطلاح بوراکس به تعدادی مواد معدنی مربوط و وابسته یا ترکیبات شیمیایی که در محتوی آب کریستاله متفاوت اند داده میشود ولی معمولا به دکاهیدرات(ده هیدراته)ها اطلاق میشود .بوراکس تجاری معمولا بصورت جزئی دهیدراته است. واژه ی بوراکس از (بورق) عربی به معنای سفید ̨ چیزی که در اصل از واژه ی پهلوی (بورک) گرفته شده که ممکن است پتاسیم نیترات یا فلاکس دیگری باشد که اکنون به نام بوره شناخته میشود.نام دیگر بوراکس نتکار(بوره طبیعی) که یک واژه ی سانسکریتیست میباشد . بوراکس برای اولین بار در بسترهای خشک دریاچه در تبت کشف شد و از مسیر ابریشم وارد کشور عربستان شد.
بوراکس، کانی اصلی دکا هیدرات Na2B4O7. 10H2O و 5/36% B2O3=از مهمترین کانیهای گروه بوراته محسوب میشود و به صورت بلورهای مونوکلینیک شیشهای روشن تا مات و یا اجزاء بلوری اتفاق میافتد. در هوای خشک با از دست دادن مقدار آب، سفید رنگ شده و به کانی پودری سفید تیرهای بنام تینکالگونیت تغییر مییابد. بوراکس دارای ظاهری چرب و تقریباً شیرین است، براحتی قابل سوختن بوده و در آب گرم حل میشود. بوراکس با ارزش ترین ترکیب بوراته برای تهیه مواد شیمیایی تصفیه شده و هم بصورت یک ماده خام میباشد.
معرفی اسید ارتوبوریک :
بوریک اسید یا بوراسیک اسید یا اورتوبوریک اسید، یک اسید ملایم است که بیشتر به منظور ضدعفونی کردن و گندزدایی و همچنین برای کنترل سرعت شکافت هستهای در کارخانههای انرژی هستهای استفاده میشود. بوریک اسید همچنین به عنوان پیش ماده برای برخی مواد دیگر نیز محسوب میشود.
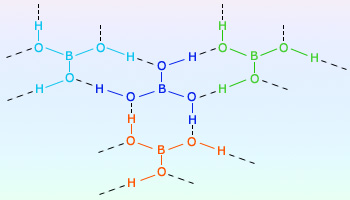
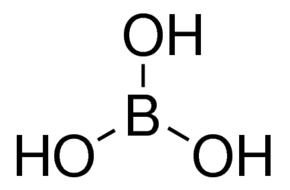
بوریک اسید به دو صورت بلورهای بیرنگ و یا پودر سفید حلال در آب وجود دارد. فرمول شیمیایی آن H3BO3 یا B(OH)3 میباشد.
ویژگی های اسید بوریک:
ü Molar mass: 61.83 g/mol
ü Formula: H3BO3
ü Melting point: 170.9 °C
ü Density: 1.44 g/cm³
ü Boiling point: 300 °C
ü Soluble in: Water
ü IUPAC ID: Trihydrooxidoboron, Boric acid
کاربرد اسید ارتوبوریک :
بوریک اسید یا بوراسیک اسید یا اورتوبوریک اسید، یک اسید ملایم است که بیشتر به منظور ضدعفونی کردن و گندزدایی و همچنین برای کنترل سرعت شکافت هستهای در کارخانههای انرژی هستهای استفاده میشود. بوریک اسید همچنین به عنوان پیش ماده برای برخی مواد دیگر نیز محسوب میشود و در صنعت آبکاری مورد استفاده قرار میگیرد. کاربرد درمانی اسید بوریک: محلول بوریک اسید در درمان بیماریها کاربرد داشته و همچنین در محلولهای شستشوی چشمی و پمادهای ضد سوختگی موجود میباشد. از بوریک اسید به عنوان حشره کش نیز استفاده میشود.
کاربرد اسید بوریک در
پزشکی و درمان
محلول بوریک اسید در درمان
عفونت قارچی مهبل، تبخال و آکنه کاربرد داشته و همچنین در محلولهای شستشوی چشمی و
پمادهای ضد سوختگی موجود میباشد. از بوریک اسید به عنوان حشره کش نیز استفاده میشود.
استفاده از بوریک اسید در درمان عفونتهای قارچی که عاملی به غیر از کاندیدا
آلبیکانز داشتهاند و داروهای موجود بر آنها مؤثر نبوده است، تجویز میشود.
کاربرد اسید بوریک در صنعت :
1. در کشاورزی
2. تولید حشره کشها
3. در صنعت جواهر سازی
4. در تولید کاشی و سرامیک
5. داروی گندزدا و ضدعفونی کننده برای سوختگی ها یا برش های سطحی
6. آبکاری و ...
تهیه بوریک اسید H3BO3 یا B(OH)3
بوریک اسید را میتوان از واکنش بوراکس با یک اسید معدنی مانند هیدروکلریک اسید تهیه کرد.
Na2B4O7·10H2O + 2 HCl → 4 B(OH)3 [or H3BO3] + 2 NaCl + 5 H2O
همچنین میتوان آن را با استفاده از هیدرولیز بورتیرهالیدها و دیبورانها تهیه کرد:
B2H6 + 6 H2O → 2 B(OH)3 + 6 H2
(BX3 + 3 H2O → B(OH)3 + 3 HX (X = Cl, Br, I
روش های کلی تشخیص و شناسایی رسوبات و بلور ها از یکدیگر
یکی از روشهای مهم در شیمی تجزیه ،
انحلال نمونه و سپس شناسایی آن به روشهای مختلف میباشد. هر ماده ،
بسته به خواص فیزیکی و شیمیایی خود در حلال خاصی
حل میشود. اغلب مواد در آب ،
محلول رقیق یا غلیظ اسیدهای معدنی ، قابل حل هستند. برای شناسایی یک نمونه مجهول میتوان فرایند انحلال آن
را در حلالهای مختلف مورد ارزیابی قرار داده ، با تجزیه و تحلیل ، نتایج آن را به
گروه خاصی از مواد نسبت داد.
روشهای انحلال نمونههای نامحلول
اگر نمونه مورد تجزیه در حلالهایی مانند آب یا
اسیدهای معدنی و ... غیر قابل حل بوده ، یا انحلال آن کم باشد، از شیوه ذوب یا خاکسترسازی استفاده میشود.
ذوباین عمل توسط حرارت دادن نمونه با برخی از
مواد به نام کمک ذوب انجام میشود. کمک ذوبها دو دسته اسیدی و بازی هستند. در عمل
ذوب ابتدا باید نمونه را سائیده ، با کمک ذوب مناسب ، مخلوط کرد. سپس بهآرامی تا
مدت معینی حرارت داده ، بعد از سرد کردن ، به آن آب یا اسید رقیق اضافه کرد تا بهصورت
محلول در آید.
سوزاندن یا خاکسترسازی
عمل سوزاندن و اکسید کردن بطور کامل ، به
دو روش انجام میشود:
اکسایش خشک :
در این روش ، نمونه را در اکسیژن هوا ، در دمای 400 700 درجه
میسوزانند. از روشهای سوزاندن در هوا میتوان به سوختن نمونه در یک کوره الکترولیز اشاره
کرد. در مورد سوختن در اکسیژن ، ممکن است جسم در مجاورت اکسیژن و تحت فشار در یک
ظرف سر بسته سوزانده شود، مانند سوزاندن در بمب کالریمتر. یا ممکن است جسم در
جریان اکسیژن سوزانده شود.
اکسایش مرطوب :
در این روش ، از مواد اکسنده برای انحلال نمونه استفاده میشود، مانند H2SO4 , H2O2 غلیظ
یا مخلوط آنها ، اسید پرکلریک یا مخلوط H2SO4 با H2O2 گاهی
از موادی مانند سولفات مس نیز به عنوان کاتالیزور مقدار کمی به این مخلوطها اضافه میشود. در این
روش ، مواد اکسنده و کاتالیزور را به نمونه افزوده ، ظرف را چند ساعت گرما میدهیم،
تا محلول شفافی بدست آید.
شناسایی گونهها (به طور کلی)
بعد از انحلال نمونه میتوانیم بوسیله طیف
نمایی یا واکنشهای شیمیایی ویژه ، بهسرعت به شناسایی گونههای موجود اقدام کنیم. در مورد
شناسایی کاتیونها و آنیونها ، روشهای کلاسیک بر اساس رسوب دادن و واکنشهای رنگی وجود دارد.
استفاده از H2 برای شناسایی و جداسازی یونهای فلزی ، روشی خسته کننده ، طولانی
و خطرناک است.
بنابراین واکنشهای ویژه و گزینشی یونها که اغلب به روش
قطرهای انجام میگیرد، بر دیگر شیوهها برتری دارد. بهعنوان مثال ، شناساگر 2 و 2 بی کینولین درمعرف PH حدود
5 تا 6 با یونCu+ ، رنگ بنفش میدهد
و بر سایر یونها اثری ندارد. در اغلب اوقات ، شناسایی ، توأم با مرحله جداسازی است.
تبلور
تبلور براساس تفاوت حلالیت اجسام ، انجام می شود.
تقطیر
تقطیر ، تولید گاز یا بخار از مایع با گرم کردن آن و تبدیل بخار به مایع بوسیله خنک کردن صورت میگیرد.
رسوب دادن
رسوب دادن ، براساس اختلاف حلالیت اجسام میباشد. در PH معین ، وقتی واکنشگر رسوب دهنده را بر روی محلول نمونه بریزیم، رسوبی که حلالیت آن کمتر است، زودتر جدا میشود.
استخراج با حلال
استخراج با حلال ، براساس انحلال نسبی جسم بین دو فاز انجام میشود.
کروماتوگرافی
کروماتوگرافی ، یک روش فیزیکی برای جدا کردن و خالص سازی ترکیبات براساس جذب سطحی مواد و توزیع آنها بین دو فاز استوار است.
تبادل یونی
تبادل یونی ، براساس تبادل برگشت پذیر یونها بین محلول و فاز جامد (مثلا رزین ) استوار است.
شناور سازی
در روش شناور سازی ، ذرات ریز جامد در محلول معلق شده ، سپس در سطح محلول شناور میگردند.
نگاه جزئی تر به مبحث جداسازی
هدف از جداسازی ، حذف مزاحمتها ، غلیظ کردن محلول مورد نظر و یا سایر موارد است. برای جداسازی از اختلاف در خصوصیات فیزیکی استفاده میشود، مثل فراریت ، حلالیت و ضریب تقسیم مواد__ و ... . در آنالیز و جداسازی مواد مختلف از تکنیکهای ویژهای برحسب نوع و ساختار مواد و مخلوطها استفاده میشود که برخی از آنها که معروف بوده و حائز اهمیت بیشتری هستند، در زیر میآوریم.
تبلور
هدف از تبلور ، جداسازی ناخالصی از اجسام جامد است.
در این روش ، ابتدا جامد ناخالص
را در یک حلال گرم
حل میکنند، سپس محلول را صاف میکنند. ناخالصیها در فاز مایع باقی میمانند. اگر
تبلور طی چند مرحله صورت گیرد، به آن تبلور
جزء به جزء میگویند.
در این روش انتخاب حلال از اهمیت بالایی برخوردار است. اگر از تکنیک ذوب برای
جداسازی ناخالصی از جامد استفاده شود، به آن تصفیه
ذوب گویند.
این روش در جدا کردن ناخالصیهای ژرمانیم و اسید
بتروییک کاربرد
دارد. در این فرآیند ، ضریب تقسیم برابر با نسبت غلظت ناخالصی در فاز جامد به غلظت
ناخالصی در فاز مایع است.
تقطیر
اگر هدف از تقطیر ، جداسازی یک مخلوط به اجزای بالا باشد،
از تقطیر ساده برای جداسازی اجزاء استفاده میشود. اما اگر همه اجزاء فرار باشند،
از تقطیر جزء به جزء برای جداسازی استفاده میشود. اگر یک مخلوط تولید آزئوتروپ کند، ( مثل آب و الکل) نمیتوان از روش تقطیر جزء به جزء ، اجزای آن را جدا کرد. برای
جداسازی این مخلوط از روشهای تقطیر
با بخار آب ، تقطیر
در خلاء و تقطیر
ناگهانی استفاده
میکنند.
در تقطیر با بخار آب هیچگاه درجه حرارت تقطیر از نقطه جوش
آب بیشتر نمیشود. ترکیباتی نظیر تولوئن ، اتیلن ، گلیسیرین و اسیدهای چرب از
این طریق جدا میشوند. برای جلوگیری از تجزیه مایعاتی که دارای نقطه جوش بالایی هستند از تقطیر
در خلاء استفاده
میشود. با کاهش فشار ، نقطه جوش مایع کاهش پیدا میکند.
در تهیه آب
آشامیدنی از
آب دریا و تهیه آب مقطر نیروگاهها از تقطیر ناگهانی استفاده میشود. در این روش
مایع بطور مداوم وارد و بخار بطور مداوم خارج میشود.
رسوب دادن
نوعی روش جداسازی است که اساس آن اختلاف حلالیت
اجسام میباشد. یعنی جزیی که حلالیت کمتری دارد زودتر جدا میشود. با افزایش نیروی
جاذبه سرعت تهنشین شدن افزایش پیدا میکند. عمل
سانتریفوژ در
واقع بر همین اساس است.
استخراج
اساس این روش ، اختلاف حلالیت یک جزء در دو حلال غیر قابل
حل در یکدیگر است. اگر دو حلال غیر قابل استخراج ، مایع باشند، به این روش استخراج
مایع ـ مایع گویند
و اگر یک جسم جامد به وسیله یک حلال استخراج شود، به آن استخراج
جامد ـ مایع گویند
(مثل استخراج اسانسها ، عصارهها و روغن از دانههای گیاهی). عموما دو فاز مورد
استفاده ، یکی آب است و دیگری یک حلال
آلی.
مقداری از جسم در فاز آبی و مقداری نیز در فاز آلی میباشد.
بازده استخراج با ضریب تقسیم نسبت مستقیم دارد. دوبار استخراج با حجم کمتر از حلال
آلی همیشه موثر از یک بار استخراج با حجمی مساوی دو برابر حجم اول است. چون در
حالت اول ، مقدار وزن ماده باقیمانده محلول در آب ، کمتر از حالت دوم خواهد بود.
کروماتوگرافی
اساس کروماتوگرافی ، جذب سطحی مواد و توزیع آنها در دو فاز میباشد. یکی از فازها
ثابت و فاز دیگر متحرک است که نمونه مورد نظر در فاز متحرک جدا میشود. فاز ثابت
یا جامد است و یا مایع و فاز متحرک یا مایع است و یا گاز .
اگر فاز ثابت ، جامد و فاز متحرک ، مایع باشد، به آن کروماتوگرافی
مایع ـ جامد ( LSC ) گویند. اگر فاز متحرک ، گاز و
فاز ثابت ، جامد باشد، به آن کروماتوگرافی
گاز - جامد ( GSC ) گویند. اگر فاز متحرک ، مایع
و فاز ثابت نیز مایع باشد به آن کروماتوگرافی
مایع ـ مایع (
LLC یا
HPLC ) گویند و در نهایت اگر فاز متحرک ، گاز و
فاز ثابت ، مایع باشد، به آن کروماتوگرافی
گاز - مایع (
GLC یا
VPC ) گویند.
در LSC ، جدا شدن بر اساس جذب سطحی یا تعریض یونها و یا تشکیل کمپلکس میباشد.
در GSC اساس ، جداسازی جذب سطحی است. در LLC و GLC ، مواد بر اساس توزیع بین دو فاز جدا میشوند. پس کروماتوگرافی
روشی برای جداسازی مخلوط بدلیل اختلاف تحرک آنها میباشد.
کروماتوگرافی LSC در واقع نوعی کروماتوموگرافی جذبی است که مواد بر اساس اختلاف
در قابلیت جذب خود روی سطح جامد از یکدیگر جدا میشوند. در GSC نیز اساس جداسازی جذب سطحی فاز گاز روی سطح جامد است. از این
روش برای خالص سازی گازها استفاده میشود.
کروماتوگرافی تبادل یونی
کروماتوگرافی تبادل یونی ، روشی است که در آن ، یونها بین یک محلول و یک فاز جامد ( رزین ) مبادله میشوند. این تبادل ، برگشت پذیر است. فاز جامد در آب ، غیر محلول بوده و دارای بنیانهای اسیدی و بازی باشد. نوع معدنی این مواد جامد ، ممکن است شبیه زئولیتها باشند و نوع جدید آنها از مشتقات هستند و برای جداسازی فلزات قلیایی خاکی بکار میروند. رزینهای تبادل یونی ، منشا آلی دارند و از پلیمرهای با وزن مولکولی بالا ساخته میشوند.تشکیل این رزینها بر اساس پلیمریزاسیون پلیاستیرن و وینیلبنزن استوار است. رزینها به دو نوع تعویض کننده آنیونی و کاتیونی تقسیم میشوند. هر کدام از این تعویض کنندهها به نوع بازی ضعیف و قوی و اسیدی ضعیف و قوی تقسیم میشوند.
صاف کردن
عمل صاف کردن، روش های مختلفی دارد که اساس و پایه همه ی آن ها عمل صاف کردن ساده است که به وسیله ی یک کاغذ صافی و قیف انجام می شود که به صورت زیر است:
قیفی تمیز بردارید و آن را بالای ارلن بگذارید. کاغذ صافی را بردارید.
آن را از وسط تا نموده و دوباره از نیمه یک تای دیگر به آن بزنید که باید به شکل زیر در بیاید.
گوشه ی آن را ببرید - این کار به قرار گرفتن کاغذ صافی در قیف کمک می کند و در نتیجه حبابی بین قیف و کاغذ صافی به وجود نمی آید.
دکانته کردن
برای جدا سازی یک مخلوط ناهمگن بدون توجه به دقت کار و برای بالا بردن سرعت می توان از کانته کردن استفاده کرد. دکانته کردن، روشی است که می توان مایع را از جامد با سرعتی بالا اما دقتی کم جدا کرد.
البته قبل از جدا کردن کامل مایع و جامد باید آن ها را در ظرف مشترک خود به دو بخش (مثلاً جامد در ته ظرف و مایع روی آن) تقسیم کرد که در برخی آزمایش ها که ذرات کلوییدی هستند می توان از الکترولیت استفاده کرد، در آزمایش هایی که رسوب تشکیل شده، می توان ظرف مورد نظر را برای مدتی در حال سکون قرار داد.
برای مواردی که قصد دارید زمان کمتری صرف کنید و می توان از سانتریفوژ کردن (در ادامه توضیحات بیشتری در مورد سانتریفوژ داده خواهد شد) استفاده کرد، که وجه اشتراک تمام این موارد این است که ذرات معلق جامد در ته ظرف می نشینند، آن گاه می توانید مایع بالای مواد جامد را سر ریز کنید.
می توانید از میله ی شیشه ای (آژیتاتور) برای ریختن مایع کمک بگیرید. در این صورت مایع سریع تر سر ریز می شود و در ضمن با ته میله می توانید مواد جامد را نگه دارید تا با مایع بیرون نیایند.
در هنگام سر ریز کردن، مایع بالای مواد جامد را درون ظرفی دیگر سر ریز کنید. زمانی که مشاهده کردید مواد جامد در آستانه ی بیرون ریختن می باشند، کار را پایان دهید.
در نظر داشته باشید که این روش سریع و البته با دقت پایین است.
در موقع سر ریز کردن مایع، سعی کنید عملیات را با سرعت بالایی انجام دهید و هنگام سر ریز کردن ظرف را خیلی تکان ندهید.
سانتریفوژ
سانتریفوژ، روشی برای جداسازی مواد در مخلوط بر اساس تفاوت چگالی آن هاست، ماده ی چگال تر به انتهای لوله ی آزمایش خواهد رفت و ماده ی با چگالی کمتر، بالای آن قرار می گیرد.
برای استفاده از دستگاه سانتریفوژ، لوله های آزمایش مخصوص خود دستگاه را برداشته و مخلوط مورد نظر را در آن ریخته و رو به روی آن یک لوله ی آزمایش مشابه دیگر امّا این دفعه حاوی آب برای برقراری تعادل دستگاه قرار دهید.زمانی که از تعادل (balance) سانتریفوژ اطمینان داشتید، آن را روشن کنید و بگذارید برای یک دقیقه کار کند. اگر سانتریفوژ صدای زیادی تولید می کند آن را خاموش کرده و بالانس بودن (تعادل) آن را کنترل کنید.در تمام مدت زمانی که دستگاه سانتریفوژ در حال کار کردن است، شما باید در کنار دستگاه بوده و به آن توجه داشته باشید. زیرا لرزش های آن هر چند کوچک می تواند موجب حرکت سانتریفوژ و افتادن آن از روی میز شود.





بسیار عالی ، دستتون درد نکنه شما و امثال شما بصورت رایگان مردمو راهنمایی میکنید