تیتراسیون
تیتراسیون در علم شیمی عبارت است از تعیین غلظت یک محلول مجهول با روشهای مختلف. یک روش آزمایشگاهی معمول کمّی در شیمی تجزیه است، که برای اندازهگیری غلظت نامعلوم یک آنالیت استفاده میشود. از شناخته شده ترین تیتراسیونها، تیتراسیون حجم سنجی اسید و باز است. چون اندازهگیری حجم در تیتراسیون خیلی مهم است، آن را آنالیز حجمی نیز مینامند. یک واکنشگر ناب که تیترانت یا تیتراتور نامیده میشود، به عنوان یک محلول مناسب استفاده میگردد. یک حجم از تیترانت با غلظت مشخص با یک محلول یا آنالیت واکنش میدهد، تا غلظتش مشخص شود. حجم تیترانت واکنش داده را تیتر مینامند.
روشها
ü تیتراسیون حجم سنجی
این روش بر اندازه گیری حجم دقیق یک محلول استوار است. در این روش محلول با غلظت معین که محلول استاندارد نام دارد در بورت ریخته میشود، و محلول با غلظت نامعلوم که محلول مجهول نام دارد در یک ارلن ریخته میشود. فرآیند تیتر کردن که عبارت است از افزودن قطره قطره محلول معلوم به محلول مجهول، تا زمانی که واکنش بین دو ماده کامل شود ادامه دارد. برای تشخیص کامل شدن واکنش روشهای مختلفی به کار میرود که معروف ترین آنها استفاده از شناساگرهای شیمیایی است.
ü تیتراسیون وزن سنجی
ü تیتراسیون خنثی شدن
ü تیتراسیون کمپلکس سنجی
ü تیتراسیون پتانسیل سنجی
ü تیتراسیون اکسایش-کاهش
ü آنالیز نمونهخای خاک با تیتراسیون
روش اولیه با یک بشر یا ارلن که شامل مقدار مشخصی آنالیت و مقدار کمی شاخص که در زیر یک بورت یا پیپت کالیبره شامل تیترانت است، صورت میگیرد. مقدار کمی تیترانت به آنالیت و شاخص اضافه میشود تا وقتی که شاخص شروع به تغییر کند، که شروع نقطه همارزی است. با توجه به نقطه همارزی مورد نظر، یک قطره یا کمتر از تیترانت میتواند اختلافی دائمی یا موقت در شاخص ایجاد کند. وقتی نقطه همارزی واکنش فرا رسید، حجم مصرفی واکنش دهنده اندازهگیری شده و غلظت آنالیت با فرمول زیر حساب میشود.
روشهای آمادهسازی
معمولا تیتراسیون به تیترانت و آنالیت به صورت مایع نیاز دارد. گرچه مواد جامد نیز در یک حلال آبی حل میشود، حلالهای دیگر مثل اتانول و استیک اسید برای موارد دیگر استفاده میشود.(مانند پتروشیمی) آنالیتهای تغلیظ شده برای بالا بردن دقت، رقیق میشوند. تیتراسیونهای بدون اسید، نیازمند پیاچ ثابت در طول واکنش هستند؛ بنابراین، ممکن است محلول بافر به محفظه تیتراسیون اضافه شود تا پیاچ را ثابت نگه دارد.
منحنی تیتراسیون
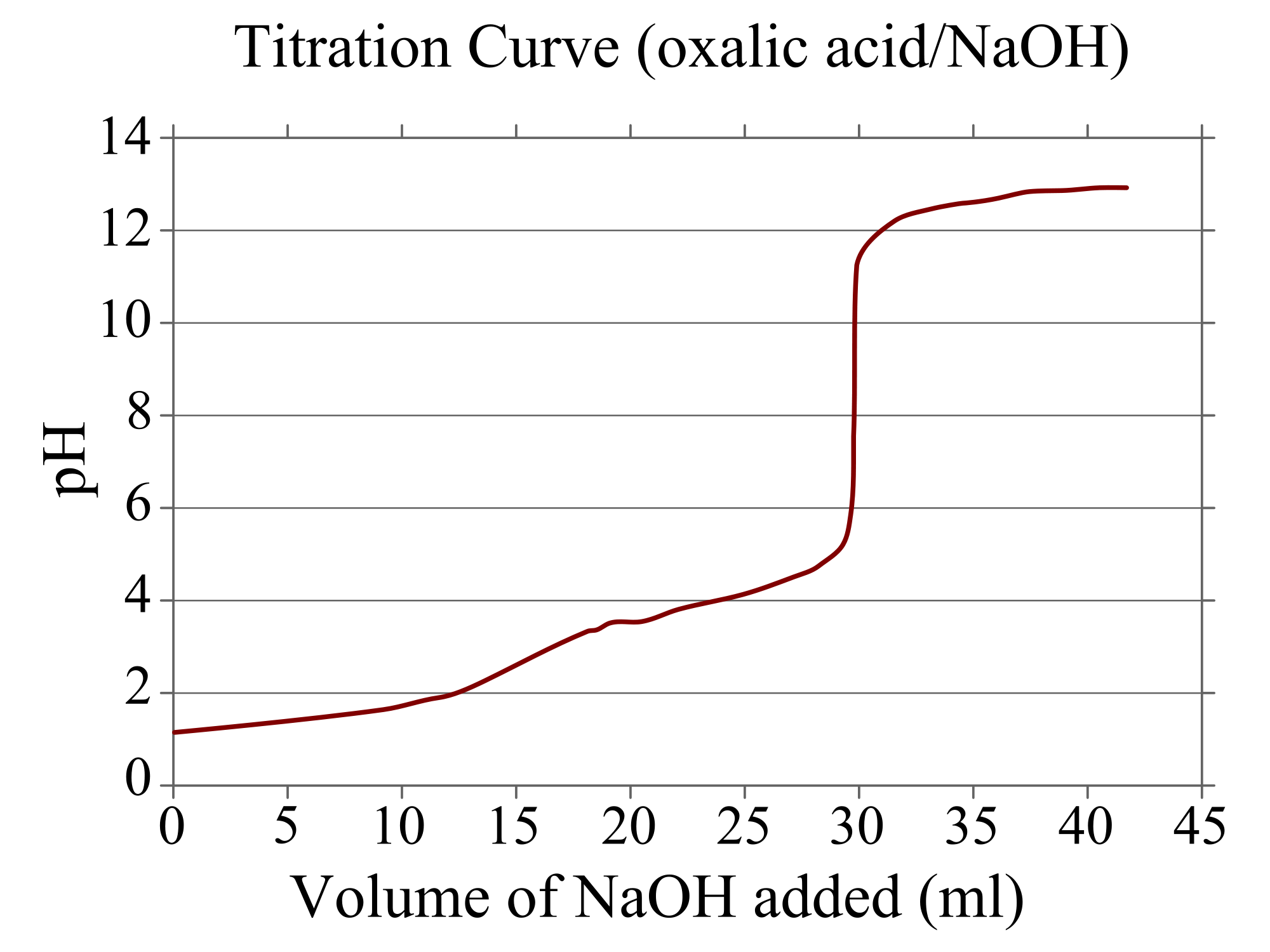
منحنی معمول تیتراسیون اسید دیپروتیک که با پایه قوی تیتر میشود؛ که تیتر شدن اکسالیک اسید با سدیم هیدروکسید نشان داده شده است. هر دو نقطه همارزی قابل مشاهده هستند. منحنی تیتراسیون منحنی است که محور x آن حجم تیترانتی را نشان میدهد که از اول واکنش اضافه شده است، و محور y هم غلطت آنالیت در آن حجم میباشد (در موارد اسیدی محور y پیاچ حلال را نشان میدهد.
در تیتراسیون اسیدی، منحنی تیتراسیون قدرت اسید و پایه را نشان میدهد. برای یک اسید و باز قوی، منحنی ملایم و با شیب زیاد در نقطه همارزی خواهد بود. به همین دلیل، یک تغییر کوچک در حجم تیترانت در نزدیک نقطه همارزی، پیاچ را به شدت تغییر میدهد و شاخصهای زیادی را برای آن میتوان اختصاص داد (برای مثال کاغذ تورنسل، فنول فتالئین یا برموتیمول آبی).
اگر در شرایطی یکی از دو
عامل اسید و باز قوی و دیگری ضعیف باشد، منحنی نامنظم خواهد بود و با تغییر کم حجم
در نزدیکی نقطه همارزی، پیاچ کمتر تغییر میکند. برای مثال، منحنی تیتراسیون،
اسید اگزالیک (اسید ضعیف) با سدیم هیدروکسید (باز قوی) نشان داده شده است. نقطه همارزی
بین پیاچ ۸-۱۰ اتفاق میافتد، این
موضوع نشان میدهد که حلال در نقطه همارزی خاصیت باز را دارد و نشانگر مورد نظر
فنول فتالئین است. منحنی تیتراسیون برای یک اسد قوی و
باز ضعیف نیز این چنین است و حلال خاصیت اسیدی گرفته و باید از شاخصهای متیل
اورانژ و برموتیمول آبیاستفاده شود.
تیتراسیون بین اسید ضعیف و
باز ضعیف دارای نامنظمی شدید است، به همین دلیل، یک شناساگر قطعی برای این حالت
وجود ندارد و از یک پیاچ سنج برای نشان دادن واکنش استفاده می شود. تابعی که میتوان برای توصیف منحنی
استفاده کرد تابع سیگموئید است.
انواع تیتراسیون
انواع مختلفی از تیتراسیون با روشها و اهداف مختلف وجود دارد و رایجترین انواع تیتراسیئن کیفی عبارتاند از: تیتراسیون اسید-باز و تیتراسیون اکسایشی و کاهشی.
|
رنگ در محیط اسیدی |
بازه تغییرات رنگ |
رنگ در محیط بازی |
|
|
تیل ارغوانی |
زرد |
۰.۰ - ۱.۶ |
ارغوانی |
|
بروموفنول آبی |
زرد |
۳.۰ - ۴.۶ |
آبی |
|
قرمز |
۳.۱ - ۴.۴ |
زرد |
|
|
متیل قرمز |
قرمز |
۴.۴ - ۶.۳ |
زرد |
|
قرمز |
۵.۰ - ۸.۰ |
آبی |
|
|
زرد |
۶.۰ - ۷.۶ |
آبی |
|
|
بی رنگ |
۸.۳ - ۱۰.۰ |
ارغوانی |
|
|
آلیزارین زرد |
زرد |
۱۰.۱ - ۱۲.۰ |
قرمز |
تیتراسیون اسید- باز به خنثی
شدن اسید و باز هنگامی که با حلال مخلوط شدند ربط دارد. علاوه بر نمونه، شناساگر
پیاچ که به محلول اضافه میشود، در نشان دادن نقطه همارزی مؤثر است. شناساگر
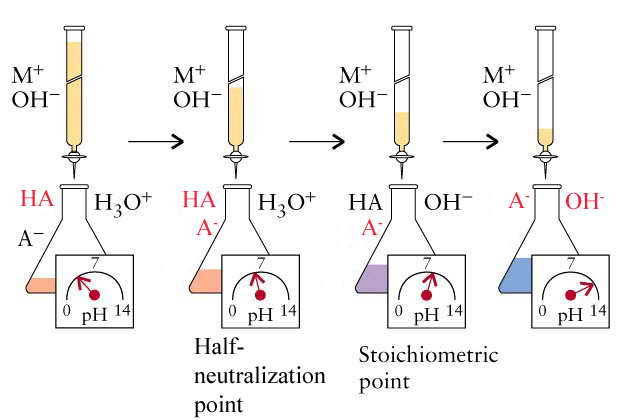
تیتراسیون اسید باز با تغییر رنگ، نقطه همارزی را نشان میدهد. نقطه پایانی و
نقطه همارزی حتما یکی نیستند، زیرا نقطه همارزی با استکیومتری واکنش مشخص میشود،
ولی نقطه پایانی صرفا با تغییر رنگ مشخص میگردد؛ بنابراین برای کاهش خطا باید
شناساگر مناسبی انتخاب شود. برای مثال، اگر نقطه همارزی در پیاچ ۸٫۴
باشد، استفاده از فنول فتالئین به جای آلیزارین زرد، خطا را کاهش میدهد.
شناساگرهای معروف و رنگشان و پیاچ ای که تغییر رنگ میدهند، در جدول بالا آمده
است.
برای جوابهای دقیقتر، وقتی که یک اسید یا باز ضعیف موجود باشد، پیاچ سنج یا هدایت سنج مورد استفاده قرار میگیرد.
برای بازهای خیلی قوی مانند هیدرید و آمینه آهن، آب به عنوان حلال مناسبی شناخته نمیشود، به جای آن از اسیدهای خیلی ضعیف و حلالهای بی آب مانند تتراهیدروفوران برای تیترانت و شناساگر استفاده میشود.
شناساگرها یا معرف ها مادههایی هستند که با کمک آنها میتوان تشخیص داد که محلولی اسیدی یا بازی است. در حالت کلی، شناساگرها مادهای رنگی هستند که معمولاً از مواد گیاهی بدست می آیند و میتوانند به شکل اسیدی یا بازی موجودیت یابند. شناساگرها برای شناسایی اسیدها و بازها به ما کمک میکنند.
+ برای تعیین نقطه پایان در حین تیتر کردن از ترکیبات شیمیایی مشخص استفاده میشود که در نزدیکی نقطه تعادل در اثر تغییر غلظت مواد تیترشونده شروع به تغییر رنگ میکنند. این ترکیبات، مواد رنگی شناساگر میباشند. به عبارتی دیگر، شناساگرها مادهای رنگی هستند که رنگ آنها در محیط اسیدی و قلیایی با هم تفاوت دارد.
انواع تیتر کردن
بر حسب واکنشهایی که بین محلول تیتر شونده و استاندارد صورت میگیرد، تجزیههای حجمی (تیتراسیون) به دو دسته تقسیم میشوند:
ü روشهایی که بر اساس ترکیب یونها هستند. یعنی تغییر ظرفیت در فعل و انفعالات مربوط به آن صورت نمیگیرد. این روشها عبارت اند از:
∞ واکنشهای خنثی شدن یا واکنشهای اسید و باز
∞ واکنشهای رسوبی
∞ واکنشهایی که تولید ترکیبات کمپلکس میکنند.
ü روشهایی که بر اساس انتقال الکترون هستند؛ مانند :
∞ واکنشهای اکسایش و کاهش
تیتر کردن واکنش های اسید و باز یا خنثی شدن
تیتر کردن ، عبارت است از تعیین مقدار اسید یا باز موجود در یک محلول که با افزایش تدریجی یک باز به غلظت مشخص یا بر عکس انجام میگیرد. موقعی که محلول یک باز دارای یونهای -OH است به محلول اسید اضافه کنیم، واکنش خنثی شدن انجام میشود:
کاربرد شناساگرها
یکی از ساده ترین راه تخمین کمی PH، استفاده از یک شناساگر است. با افزودن مقدار کمی از یک شناساگر به یک محلول، تشخیص اسیدی یا بازی بودن آن ممکن میشود. در صورت مشخص بودن PH، تغییر شناساگر از یک شکل به شکل دیگر، با توجه به رنگ مشاهده شده، میتوان تعیین کرد که PH محلول کمتر یا بیشتر از این مقدار است. شیمیدانها از این گونه مواد برای شناسایی اسیدها و بازها کمک میگیرند.
شناساگرهای زیادی وجود دارد که معروفترین آنها لیتموس (تورنسل) است که در محیط اسیدی، قرمز، در محیط بازی، آبی و در حدود خنثی بنفش رنگ است. تغییر رنگ آن در نزدیکی PH برابر ۷ رخ میدهد. در هر حال تغییر رنگ ناگهانی نیست. فنل فتالئین، معرف دیگری است که بیشتر برای بازها قابل استفاده است. این ماده جامدی سفید رنگ است که در آزمایشگاه محلول الکلی آن را بکار میبرند. این محلول در محیط اسیدی بی رنگ و در محیط قلیایی رقیق ارغوانی است.
میتوان از آب کلم سرخ نیز بهعنوان یک شناساگر اسید و باز استفاده کرد. از آمیختن شناساگرهای مختلف با یکدیگر نوار کاغذی بدست میآید که با یک مقیاس رنگ مقایسهای همراه است و برای اندازه گیریهای تقریبی PH بطور گسترده کاربرد دارد.
انواع شناساگرها
شناساگر داخلی: اگر به محلول تیتر شونده، چند قطره از یک شناساگر افزوده شود و پس از پایان عمل تغییر رنگ در محلول ایجاد شود، چنین شناساگری را شناساگر داخلی یا درونی نامند.
شناساگر خارجی: در برخی حالات قبل از آن که نقطه پایان به ظهور برسد، بین شناساگر و محلول تیتر شونده یک واکنش صورت میگیرد و در این حالت نقطه پایان بسیار سریع پدیدار میشود، مثل تیتر کردن فسفات با استات اورانیل در حضور شناساگر فروسیانور پتاسیم، فروسیانور پتاسیم با یونهای اورانیل قبل از رسیدن به نقطه پایان واکنش میدهد.
برای بدست آوردن نتیجه صحیح و خوب باید به دفعات لازم چند قطره از محلول بالای رسوب ( یا محلولی که پس از صاف کردن رسوب بدست میآید ) را در فاصله زمانهای مساوی، روی یک قطعه کاغذ صافی با شناساگر سیانور پتاسیم آزمایش کرد. چنین شناساگری، شناساگر خارجی نامیده میشود.
شناساگرها، ترکیبات آلی با ساختار پیچیده هستند که به صورت اسید یا باز ضعیف عمل میکنند. واکنشهای تفکیک و تجمع شناساگرها با نوآرایی ساختمانی درونی همراه است که سبب تغییر در رنگ میشود. انواع گوناگونی از ترکیبات، هم سنتزی و هم طبیعی وجود دارند که بر حسب PH محلولی که در آن حل میشوند، رنگ متفاوتی به خود میگیرند. بعضی از این مواد هزاران سال است که برای نشان دادن خصلت اسیدی یا بازی آبها بکار گرفته شدهاند. این ترکیبات همچنین برای شیمیدان عصر حاضر که از آنها برای تخمین PH محلولها و تشخیص نقطه پایانی در تیتراسیونهای اسید – باز سود میبرند، اهمیت زیادی دارند.
رنگ شناساگر
محلولی که محتوی یک شناساگر
باشد، با تغییرات PH، یک تغییر پیوسته در رنگ از خود ظاهر میسازد.
لکن، چشم انسان به این تغییرات حساس نیست. نوعاً از یک گونه باید پنج تا ده برابر
بطور اضافی موجود باشد تا رنگ آن گونه به چشم بیننده یک رنگ غالب به نظر آید.
افزایش بیشتر در این نسبت هیچ تاثیر قابل روئیتی ندارد. فقط در ناحیهای که نسبت
از پنج تا ده برابر برای یک شکل به نسبت مشابهی برای یک شکل تغییر کند، بنظر میآید
که رنگ محلول تغییر کرده است.
پس، تغییر رنگ صوری شامل یک
تغییر عمده در وضعیت تعادل شناساگر است. بعضی از شناساگرها نیاز به تغییر نسبت
کمتری دارند و بعضی دیگر، به تغییر بیشتر. بعلاوه، تفاوت قابل توجهی نیز در توان
افراد مختلف جهت تشخیص رنگ وجود دارد. در حقیقت، شخص مبتلا به کور رنگی ممکن است
قادر به تشخیص هیچ گونه تغییر رنگی نباشد.
دامنه PH برای تغییر رنگ
دامنهای از PH که یک شناساگر معین در آن دامنه تغییر رنگ میدهد به ثبات یونش شناساگر بستگی دارد. برای شناساگرهایی که اسیدی ضعیف هستند هر اندازه ثابت یونش کوچکتر باشد، دامنه PH تغییر رنگ آن بالاتر است.
انواع شناساگر
معمولاً میتوان برای هر گستردهای از PH، شناساگری مناسب یافت. تعدادی از شناساگرهای معمولی در جدول زیر آمدهاند.
شناساگرهای فتالین اکثر شناساگرهای فتالین (فتالئین) در محلولهای اسیدی ملایم، بیرنگاند، و در محیط قلیایی رنگهای گوناگونی از خود ظاهر میکنند. در محلولهای قلیایی شدید، رنگ این شناساگر بتدریج محو میشود که در بعضی از کاربردها این امر پدیده نامناسبی است و بصورت یک گروه، فتالینها در آب بسختی حل میشوند و حلال معمولی این گروه از شناساگرها، اتانول است. معروفترین شناساگر فتالین، فنل فتالین است.
شناساگرهای سولفون فتالین بسیاری از سولفون فتالینها، دو گستره تغییر رنگ مفید دارند. یکی در محلولهای نسبتاً اسیدی و دیگری در محیطهای خنثی یا بازی ملایم واقع میشود. برخلاف فتالینها، رنگ بازی این گروه در محیط قلیایی پایدار است. بواسطه قدرت اسیدی قابل توجه سولفون فتالین (سولفون فتالئین)، معمولاً از نمکهای سدیم آنها جهت تهیه محلول شناساگرها استفاده میشود.
شناساگرهای آزاد
اکثر شناساگرهای آزاد با افزایش قدرت بازی، یک تغییر رنگ از قرمز زرد از خودشان میدهند. گستره انتقال آنها عموماً در قسمت اسیدی است. نمونههایی که بیشترین برخورد را با آنها داریم عبارتند از نارنجی مبیل و قرمز متیل(متیل اورانژ).
متغیرهای مؤثر بر رفتار شناساگرها
فاصلهای از PH که در آن یک شناساگر معین تغییر رنگ میدهد با دما، قدرت یونی محیط، حضور حلالهای آلی و حضور ذرات کلوئیدی تغییر میکند. بعضی از این عوامل، بخصوص دو مورد آخر، میتوانند موجب جابجایی این فاصله به اندازه یک واحد PH یا بیشتر شوند.
متیلن بلو(CI 52015) یک ترکیب شیمیایی معطر هتروسیکلیک با فرمول مولکولیC16H18N3SCl است. متیلن بلو کاربرد های متعددی در یک رشته از حیطه های مختلف از قبیل زیست شناسیوشیمی دارد. در دمای اتاق پودر جامد بی بو و سبز تیره رنگی است که وقتی در آب حل شود محلول آبی رنگی را، به دست می دهد. شکل آبدار آن به ازای هرمولکول متیلن بلو 3 مولکول آب دارد.
متیل اورانژ با فرمول شیمیایی C۱۴H۱۴N۳NaO۳ S یک ترکیب شیمیایی است. که جرم مولی آن ۳۲۷٫۳۳ g/mol میباشد. نام دیگر آن هلیانتین است. متیل اورنج یکی از شناساگرهای پهاش است. رنگ این ماده در محیط اسیدی قرمز و در محیط بازی زرد است.این ماده به دلیل حضور گروه so3 محلول در آب می باشد.
کاغذ تورنسل یا کاغذ لیتموس یکی از شناساگرهای محیط میباشد و برای شناسایی اسیدها و بازها استفاده می شود. کاغذ لیتموس به دو رنگ موجود است لیتموس آبی و لیتموس قرمز، از لیتموس آبی برای محیط اسیدی و از لیتموس قرمز برای محیط بازی استفاده می کنند. کاغذ آبی تورنسل در محیط اسیدی قرمز می شود و کاغذ قرمز تورنسل در محیط بازی آبی می شود . محلول تورنسل نیز در pH کمتر از 4.5 قرمز و در pH بالای 8.3 آبی و در محدوده دو pH که محدوده خنثی برای این شناساگر است بنفش می باشد .
تیمول بلو یکی از شناساگرهای
PH است. رنگ این ماده در
محیط اسیدی زرد و در محیط بازی آبی است.برم تیمول بلو یک معرف PH شیمیائی است که برای تشخیص اسیدها و بازهای ضعیف مورد
استفاده قرار میگیرد .
برم تیمول بلو در محلولهای خنثی به رنگ سبز است و در محلولهای اسیدی زرد رنگ و در
محلولهای بازی آبی رنگ میشود. وقتی به آن دی اکسیدکربن اضافه شود زرد رنگ میشود.
البته نمیتوان گفت برم تیمول بلو معرف دیاکسیدکربن است چون در تمام محلولهای اسیدی
زرد رنگ می شود اما چون واکنش دی اکسیدکربن با آب تولید اسید کربنیک (اسید ضعیف)
میکند که نوعی اسید است بنابراین باعث تغییر رنگ برم تیمول بلو می گردد. استفاده
از آب آهک به عنوان معرف دی اکسیدکربن بهتر و اختصاصی تر از برم تیمول بلو میباشد.
برم تیمول بلو به عنوان یک رنگ برای رنگ کردن بافتهای گیاهی(دیواره سلولی و هسته
ها) نیز مورد استفاده قرار میگیرد. از برم تیمول بلو در تانکهای پرورش ماهی برای
تعیین میزان کربنیک اسید آن استفاده می شود.
فنل فتالئین
یا فنل فتالین پودری ریزدانهٔ و سفیدرنگ و یک ترکیب شیمیایی (با چهار گونه ملکول مختلف) با فرمول C20H14O4 است. بطور معمول بعنوان شناساگر یا معرفی برای اسید و بازها استفاده شده و دارای دامنه کاربرد PH آن از ۳ تا ۷ است.
در محیط اسیدی بیرنگ و در
محیط بازی قرمز ارغوانی است و از محلول واکنش آهسته آن در مدارس، برای شناساندن
معرفها به دانش آموزان استفاده می شود. فنل فتالین در آب نامحلول است و اغلب در
آزمایشها، آنرا با الکل رقیق میکنند.
این ماده به خودی خود یک اسید ضعیف بوده و در محلول یون هیدروژن آزاد میکند. فنل فتالین در گذشته بعنوان ملین و ضد یبوست نیز استفاده میشد، اما
بخاطر خواص کارسینوژن و سرطانزایی بطور کامل از فهرست تجویز حذف گردیده است بطور عمده در شناسایی اسیدها و بازها
کاربرد دارد.
از ترکیبات آن با الکل و استفاده از آب اکسیژنه
(پراکسید ئیدروژن) در آزمایشگاههای تشخیص طبی و در بیمارستان برایتشخیص خون مخفی
(Occult
blood test) در مدفوع
استفاده میگردد.

روشهای مختلفی برای تخمین نقطه پایانی وجود دارد:
ü شناساگر: یک ماده که در اثر تغییر شیمیایی تغییر رنگ میدهد. یک شناساگر اسید- باز بر اثر تغییر پیاچ تغییر رنگ میدهد. شناساگر کاهشی هم به صورت یک قطره اضافه میشود و در نقطه پایانی تغییر رنگ میدهد.
ü پتانسیل سنج: یک ابزار که برای اندازهگیری پتانسیل الکترودها استفاده می شود. پتانسیل الکترودها در لحظه پایانی ناگهان تغییر خواهد کرد.
ü پیاچ سنج: یک پتناسیل سنج که، پتانسیل الکترونها به میزان وجود H+ حلال بستگی دارد. پیاچ حلال در طول واکنش اندازه گیری می شود، و این خیلی دقیقتر از به کار بردن شناساگر است. و در نقطه پایانی پیاچ ناگهان تغییر می کند.
ü هدایت الکتریکی: اندازه گیری یونهای موجود در حلال. غلظت یون میتواند در تیتراسیون به صورت قابل توجهی تغییر کند، که تغییر در هدایت الکتریکی را باعث می شود. فقط یونهای موجود در حلال باعث هدایت می شوند، نه همه یونهای موجود. پیشبینی تغییرات سختتر از محاسبه آن است.
ü تغییر رنگ: در بعضی واکنشها حلال بدون اضافه کردن شناساگر رنگش عوض می شود. این معمولا در اکسایش و کاهش دیده می شود، وقتی که فراورده واکنش رنگ متفاوتی با فراورده اکسایش داشته باشد.
ü تهنشینی: وقتی که فراورده جامد باشد، حین تیتراسیون تهنشینی رخ میدهد. به طور مثال، واکنش Cl- و Ag+ در نمک غیرقابل حل AgCl است. ابر تهنشینی معمولا تخمین نقطه پایانی را سخت میکند. در عوض، تیتراسیون تهنشینی باید به عنوان تیتراسیون برگشتی انجام شوند.
ü تیتراسیون همدمای در کالریمتر: یک وسیله برای اندازهگیری گرمای تولیدی یا مصرفی، برای تعیین نقطه پایانی. در تیتراسیونهای زیستشیمی مانند پیدا کردن نحوه اتصال پیشماده به آنزیماستفاده میشود.
ü تیتراسیون گرمایی: با تیتراسیون همدما متفاوت است، چون از مقدار گرمای منتقل شده برای تخمین میزان آنالیت موجود در حلال نمونه استفاده نمیشود. در عوض، نقطه پایانی با سرعت انتقال گرما تخمین زده میشود.
ü طیفبینی: اگر طیف واکنشدهندهها، فراوردهها و تیترانت معلوم باشد، برای اندازهگیری میزان نور جذب شده در حلال استفاده میشود. غلظت مواد را میتوان با قانون بیر-لامبرت بدست آورد.
ü آمپرمتر: فراوردهٔ واکنش تیتراسیون را به عنوان نتیجهٔ اکسایش یا کاهش آنالیت اندازه میگیرد. نقطه پایانی به عنوان تغییر در حال نمایش داده میشود. این روش در صورتی که تیترانت اضافی کاهش یابد، مفید خواهد بود.
ابزارها
ابزارهای کلیدی در این فرایند عبارتند از:
ü بورت
ü صفحهٔ زمینهٔ سفید (کاشی سفید) که در آن تغییر رنگ محلول نمایان باشد.
ü پیپت
ü شناساگر pH محلول (مادهٔ شاخص بسته به محلولهای گوناگون تفاوت میکند)
ü ارلن یا یک ظرف مخروطی دیگر
ü مادهٔ تیتر کننده (به انگلیسی: Titrant یا titrator) (یک محلول استاندارد با غلظت معلوم، برای نمونه محلول آبی سدیم کربنات)
ü مادهٔ تیتر شونده (به انگلیسی: titrand) (محلولی با غلظت نامعلوم)
تیتراسیون اسیدهای ضعیف
pH یک محلول اسید ضعیف که در حال تیتر شدن با یک باز قوی است، در طول فرایند
مرتب تغییر میکند.
این تغییرها را میتوان در چند گام دسته
بندی کرد:
ü pH نخستین
ü pH پیش از نقطهٔ تعادل
ü pH در نقطهٔ تعادل
ü pH پس از نقطهٔ تعادل